Los estados de la materia
Una serie de videos para comprender y explicar los estados de la materia, con ejemplos claros y definiciones.
¿Cómo se dan los cambios de estado?
Toda la explicación de manera didáctica en esta serie de videos.

AURORA BOREAL
Este fenómeno es un efecto visual causado por los materiales que se encuentran en estado de plasma en la termósfera.
Ya hemos oído hablar de los tres principales estados de la materia en la naturaleza: sólido, líquido y gaseoso. Aun así, estos no son los únicos presentes en el planeta y en el Universo. También existe el estado de plasma.
EL ESTADO SÓLIDO
La mayoría de los objetos del mundo que podemos percibir con los sentidos se encuentran en estado sólido. Los objetos y sustancias en este estado se caracterizan por tener una forma constante y definida. Esto sucede porque las partículas poseen fuerzas de atracción muy elevadas, es decir, se encuentran muy próximas unas con otras dificultando el movimiento o el cambio de posición entre ellas, sólo pueden vibrar en el lugar.
Los objetos que se encuentran en estado sólido tienen, además de forma, volumen constante, salvo algunos casos como los cauchos, gomas y otros materiales elásticos o moldeables. Esta propiedad se explica por el tipo de estructura que forman las partículas que pueden ser cristalinas, cristalizadas o amorfas.



Existen otras sustancias que no presentan ni forma ni estructura cristalina: los "sólidos amorfos". Se consideran sólidos porque conservan dos de sus principales características: que no se pueden comprimir y que son rígidos. Ejemplos de ellos son los cauchos, las gomas y los materiales plásticos, entre otros.
 El plástico es un sólido amorfo.
El plástico es un sólido amorfo.
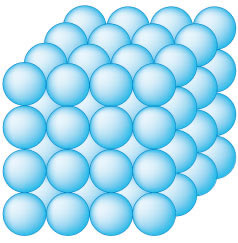 Partículas en estado sólido.
Partículas en estado sólido.
Los sólidos que presentan estructuras de tipo cristalinas tienen un ordenamiento de partículas distribuidas de forma regular en el espacio que ocupan, y componen una red cristalina. Estas redes son constantes y permanecen de forma invariable salvo que una acción externa les provoque un cambio físico.

EL ESTADO LÍQUIDO
El estado líquido se conoce como el estado intermedio de la naturaleza, debido a que en él las moléculas se encuentran más separadas que en el estado sólido, pero mucho más juntas que en el estado gaseoso. En este estado las moléculas, al poseer cierta distancia entre unas y otras, permiten determinada cantidad de movimientos que comprenden vibración, rotación e incluso traslación de dichas partículas.
Estos movimientos les permiten adaptarse a la forma del recipiente en el cual se colocan sin que su volumen varíe. Si tenemos un vaso muy angosto lleno de agua, y la cambiamos a un vaso muy ancho, el volumen seguirá siendo el mismo, sólo que se adaptó de manera distinta al recipiente.
Otra característica de los líquidos que comparten con los gases es su fluidez: la propiedad que tienen de moverse o desplazarse dentro del recipiente que los contiene. Sin embargo, poseen capacidades de compresión y dilatación relativamente bajas en comparación a los gases, pero ligeramente mayor que los sólidos.
Aumentar las dimensiones lineales de un cuerpo sin que se produzca variación de
su masa.

¿Qué son los coloides?
Se denominan sustancias coloides aquellas en las que partículas muy pequeñas se esparcen por otra sustancia (dispersor). Si bien las más comunes son aquellas que tiñen el agua, un ejemplo importante es el de la sangre. Ésta es una solución que tiene numerosos elementos disueltos.
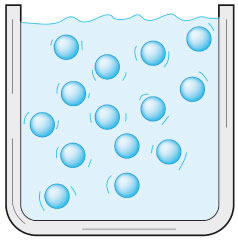 Partículas en estado líquido.
Partículas en estado líquido. El chocolate es un coloide. Además de encontrarse en estado sólido puede
El chocolate es un coloide. Además de encontrarse en estado sólido puede EL ESTADO GASEOSO
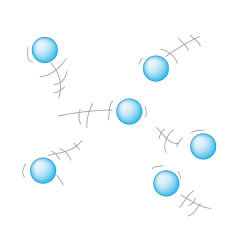 Partículas en estado gaseoso.
Partículas en estado gaseoso.El gigante que brilla
El Sol es un ejemplo de este estado. Es una estrella compuesta por iones atómicos ligeros de helio e hidrógeno, pero, si bien es la más cercana, no es la única. Las estrellas de todo el Universo tienen tan alta temperatura que sólo pueden existir en estado
de plasma.

El estado gaseoso carece de forma y volumen propio, por lo tanto, las sustancias que se encuentran en este estado ocupan el volumen del recipiente que las contiene y adaptan su forma a él. Los gases se caracterizan por la baja atracción entre las partículas que lo conforman, de hecho, suelen ser tan bajas estas interacciones que son consideradas nulas o despreciables.
Los gases, a diferencia de los sólidos y de los líquidos se pueden comprimir y dilatar con suma facilidad: esto se debe a que las partículas se encuentran muy separadas unas de otras,por lo que existe mucho espacio vacío que puede ser ocupado por partículas.
 A diferencia de los sólidos y los líquidos, los gases pueden comprimirse y almacenarse en recipientes o cilindros especiales bajo presión.
A diferencia de los sólidos y los líquidos, los gases pueden comprimirse y almacenarse en recipientes o cilindros especiales bajo presión.
¿QUÉ ES EL ESTADO PLASMA?
Es el cuarto estado de la materia con características muy distintas a las del resto de los estados. La mayor parte de la materia de nuestro Universo se encuentra en estado de plasma, que no tiene forma y volumen definidos, y cierta parte de sus partículas tiene cargas eléctricas y responde a interacciones electromagnéticas.
UN QUINTO ESTADO
En 1920 los científicos Satyendra Nath Bose y Albert Einstein publicaron un escrito en el que comenzaban a detallar un nuevo estado de la materia: el condensado de Bose-Einstein. Éste se da en algunos materiales, sólo a temperaturas cercanas a cero absoluto (la más baja posible, en la que no se registrarían movimientos o actividad de las partículas que componen el material).


nombre
Albert Einstein
Fecha de nacimiento
14 de marzo de 1879
Ocupación
Físico
Es uno de los científicos más destacados de la Historia. Cuando era muy joven publicó la teoría de la relatividad especial, y allí planteó la ecuación de la física E=mc2. Por éste y otros descubrimientos ganó el Premio Nobel de Física.
LA TEMPERATURA Y LOS CAMBIOS DE ESTADO
Existen varios factores que determinan los estados de agregación en los que se puede encontrar la materia: uno de ellos es la temperatura. Para entender esto tomemos un ejemplo de material que se encuentra en los tres estados en la naturaleza: el agua.

La lluvia se produce cuando el vapor de agua se condensa.
El agua se encuentra en forma de hielo a 0º C, punto límite en el cual puede pasar de estado sólido al líquido: a este límite se lo llama punto de fusión.Por otra parte, al alcanzar los 100 ºC pasa de ser agua líquida a gaseosa: este punto se denomina punto de ebullición y al cambio de estado, vaporización (evaporación si se realizó en condiciones normales de temperatura, o ebullición en el caso de que el agua se haya hervido). A la inversa, es decir cuando la temperatura desciende, el pasaje de gas a líquido se llama condensación, y de líquido a sólido, solidificación.
¿Cómo se denominan los cambios de estado?




¿Qué metal es líquido a temperatura ambiente?
Las temperaturas de fundición de los metales son muy elevadas para encontrarse naturalmente en estado líquido, sin embargo hay una excepción: ¡el mercurio! Puedes verlo, por ejemplo, dentro de un termómetro.

Cada sustancia tiene su punto de fusión y ebullición. Algunos de ellos son tan altos o bajos que resulta casi imposible que se encuentren naturalmente materiales en los tres estados. Un ejemplo de ello son los metales: debido a su estructura tan rígida y definida necesitan de elevadas temperaturas para que pasen del estado sólido natural a uno líquido, temperaturas que no se encuentran naturalmente en la superficie terrestre.
Podemos decir entonces que las variaciones de temperatura en un material cambian la movilidad de las partículas: cuanto mayor es la temperatura, mayor es la movilidad de las partículas, y cuanto menor es la temperatura, más tienden a atraerse las partículas y menor es su movilidad.



Los estados de la materia
Una serie de videos para comprender y explicar los estados de la materia, con ejemplos claros y definiciones.
¿Cómo se dan los cambios de estado?
Toda la explicación de manera didáctica en esta serie de videos.