
DOS EN UNA
Una gaseosa es una solución mientras la botella esté cerrada. Cuando se destapa, el dióxido de carbono se separa y da lugar a las burbujas, entonces es una mezcla heterogénea.
En la vida cotidiana observamos sustancias que son como el agua y el aceite, no se juntan. En tanto otras parecen ser una sola sustancia a simple vista, como el agua y la sal.
SISTEMAS MATERIALES
Se entiende por sistema material aquella porción de materia que es objeto de estudio, por ejemplo un gramo de arena de playa o un litro de agua de mar. Los sistemas materiales se clasifican en homogéneos y heterogéneos.

Los sistemas homogéneos son aquellos constituidos por una sola fase, esto significa que, sin importar la porción que se tome del sistema, las propiedades características serán las mismas.
Los sistemas heterogéneos están constituidos por dos o más fases. Debido a esto presentan propiedades características diferentes en función de la porción del sistema que se tome.
SUSTANCIAS PURAS
Las sustancias puras son aquellas que no se pueden separar mediante métodos físicos, como por ejemplo la filtración. Dentro de las sustancias puras se distinguen los elementos químicos formados por átomos iguales y los compuestos químicos constituidos por moléculas que pueden ser combinaciones de uno o más elementos químicos.
DESCÚBRELOS AL PASAR EL CURSOR POR LAS IMÁGENES








La fase es la porción homogénea del sistema material, en tanto, las diferentes sustancias que conforman un sistema material se denominan componentes.
 El agua con azúcar tiene una
El agua con azúcar tiene una El agua con limón tiene dos
El agua con limón tiene dos El agua con piedras tiene dos
El agua con piedras tiene dos El té es una solución con una
El té es una solución con unaDESCÚBRELOS AL PASAR EL CURSOR POR LAS IMÁGENES



Seguramente alguna vez ha visto o utilizado uno de estos productos que a simple vista parecen soluciones, sin embargo, no lo son.
En realidad son mezclas formadas por partículas microscópicas dispersas en otra sustancia y se denominan coloides. Una forma de distinguir un coloide de un solución es haciendo pasar luz a través de estas, ya que los coloides
dispersan la luz.
 Crema humectante
Crema humectante
 Gelatina
Gelatina
 Espuma de afeitar
Espuma de afeitar
 Mayonesa
Mayonesa
TIPOS DE MEZCLAS
Una mezcla es una combinación de sustancias puras que no reaccionan entre sí y se clasifican en:
LAS SOLUCIONES
Las soluciones son sistemas materiales homogéneos compuestos por uno o más solutos disueltos en un solvente determinado.
El soluto es el componente de la solución que se encuentra en menor proporción y se disuelve en el solvente, en tanto el solvente es el que se encuentra en mayor proporción y tiene la capacidad de disolver al soluto, el agua es el solvente más conocido y empleado a nivel mundial.
El agua es conocida como el solvente universal, este líquido vital es capaz de disolver una gran cantidad de compuestos, además no es tóxico y su manipulación no conlleva ninguna peligrosidad. Debido a lo cual también encabeza las listas de los denominados solventes verdes o sostenibles cada vez más importantes para la industria
y la ciencia.
No obstante, el agua no es capaz de disolver todos los compuestos que existen, Por ejemplo, no puede disolver el aceite.
Las soluciones se clasifican en función de la concentración en insaturadas, saturadas y sobresaturadas.
 El agua con el alcohol es una solución en estado líquido, donde el solvente y el soluto son líquidos.
El agua con el alcohol es una solución en estado líquido, donde el solvente y el soluto son líquidos.
 Las bebidas gaseosas son soluciones líquidas donde uno de los solutos es un gas y el solvente es un líquido.
Las bebidas gaseosas son soluciones líquidas donde uno de los solutos es un gas y el solvente es un líquido.
 El agua con sal es una solución líquida donde el soluto es un sólido y el solvente un líquido.
El agua con sal es una solución líquida donde el soluto es un sólido y el solvente un líquido.
 El aire es una solución gaseosa donde todos sus componentes son gases.
El aire es una solución gaseosa donde todos sus componentes son gases.
 El acero es una solución sólida denominada aleación, cuyos componentes son sólidos.
El acero es una solución sólida denominada aleación, cuyos componentes son sólidos.
TÉCNICAS DE SEPARACIÓN
Los componentes de una mezcla o solución pueden aislarse empleando diferentes técnicas de separación, la utilización de cada una dependerá del tipo de solución y las características particulares de sus componentes.

 Técnica de filtración.
Técnica de filtración.
 El agua se limpia con ayuda de filtros.
El agua se limpia con ayuda de filtros.
 El agua y el aceite se pueden separar por decantación.
El agua y el aceite se pueden separar por decantación.
 Los imanes atraen a las sustancias compuestas con carácter metálico.
Los imanes atraen a las sustancias compuestas con carácter metálico.
 En la repostería es común
En la repostería es común EXPERIMENTO:
EXPERIMENTO:
EL LAPICERO
Objetivo
Separar y observar los diferentes componentes de la tinta
de los lapiceros.
Materiales
- Lapicero o tinta
- Alcohol para las heridas
- Papel filtro
- Vaso de vidrio
- Lápiz
- Regla
- Palillo
Procedimiento
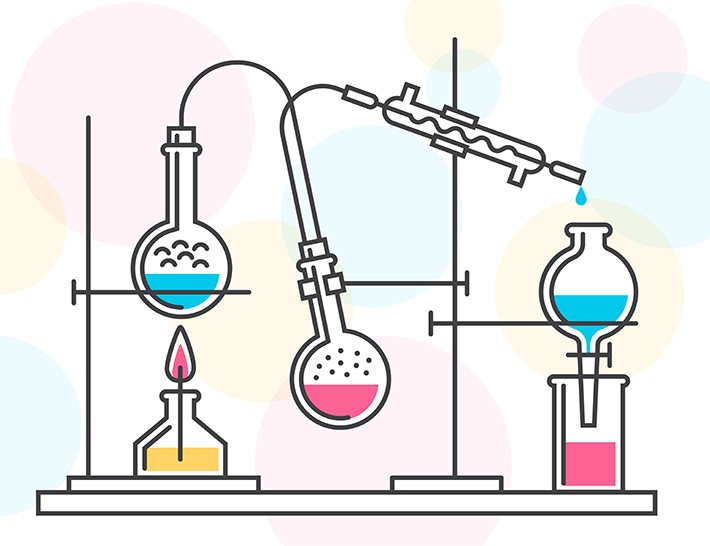 Proceso de destilación.
Proceso de destilación.
 Cromatografía en papel.
Cromatografía en papel.
En la extracción de sal se induce la formación de los cristales de sal a partir de la evaporación del agua.
 Mina de extracción de sal mediante el proceso de cristalización.
Mina de extracción de sal mediante el proceso de cristalización.

