
LEYES PONDERALES
Las leyes ponderales de las reacciones químicas son: la ley de la conservación de la materia, la ley de las proporciones definidas, la ley de proporciones recíprocas y la ley de proporciones múltiples.
La materia se encuentra en constante cambio, si el mismo involucra una transformación en la estructura química de la materia y por ende en sus propiedades, se dice que ocurre una reacción química.
LEY DE CONSERVACIÓN DE LA MATERIA
En 1783 se enunció la Ley de conservación de la materia o Ley de Lavoisier, la cual establece que:
En una reacción química la cantidad de materia es constante. Lo que significa que cuando ocurre una reacción en un sistema cerrado, la masa de los reactivos es igual a la de los productos.
A + B → C + D
Masa A + Masa B = Masa C + Masa D
 Experimento para demostrar que la cantidad de materia en una reacción es constante.
Experimento para demostrar que la cantidad de materia en una reacción es constante.
Toda ley tiene una excepción
La ley de conservación de la masa se cumple para todos los casos, excepto para las reacciones nucleares, debido a que en estos casos existe una conversión de la materia a energía que cumple con la ecuación planteada por Albert Einstein:
E = m . c2
Donde E es la energía en reposo, m la masa y c la velocidad de la luz.
 EXPERIMENTO: INFLA EL GLOBO
EXPERIMENTO: INFLA EL GLOBO
Objetivo
Demostrar que la ley de conservación de la materia se cumple para una reacción dada.
Materiales
- 50 g de vinagre
- 30 g de bicarbonato de sodio
- Matraz
- Balanza
- Globo
- Cinta adhesiva o liga de hule.
Pasos a seguir
 ¡El cuerpo humano es un laboratorio ambulante! En nuestro interior ocurren millones de reacciones químicas.
¡El cuerpo humano es un laboratorio ambulante! En nuestro interior ocurren millones de reacciones químicas.


Nombre
Antoine-Laurent de Lavoisier
Año de nacimiento
1743
Lugar de nacimiento
París, Francia
Ocupación
Químico
Legado
Ley de conservación de la materia estudió la reacción de combustión y realizó importantes aportes a la nomenclatura química.
Lavoisier fue el primero en determinar que el aire era una mezcla de varios compuestos.
 Albert Einstein dijo que “la cantidad combinada de materia y energía es constante en el universo”, una frase que resume la ley de conservación de la materia y la energía.
Albert Einstein dijo que “la cantidad combinada de materia y energía es constante en el universo”, una frase que resume la ley de conservación de la materia y la energía.
A simple vista podemos saber que ocurre una reacción química cuando observamos:
 Cambio de coloración
Cambio de coloración
 Aparición de un precipitado
Aparición de un precipitado
 Variación de temperatura
Variación de temperatura
 Desprendimiento de gas
Desprendimiento de gas
 Cambios de olor
Cambios de olor
 Cambios de pH
Cambios de pH
LAS REACCIONES QUÍMICAS
Las reacciones químicas constituyen un tipo de cambio de la materia que implica una transformación en la estructura química de la misma y por ende en sus propiedades características.
Dicho de otra forma, una reacción química describe como una o más sustancias iniciales denominadas reactivos se combinan entre sí para formar otras sustancias de características diferentes llamadas productos.
Reactivos → Productos
La energía y las reacciones
En la naturaleza, algunas reacciones no ocurren a menos que haya una absorción de energía, en tanto otras ocurren de forma espontánea y liberan energía.
- Reacciones endotérmicas: son aquellas que absorben energía.
- Reacciones exotérmicas: son aquellas que liberan energía.
 Para que la fotosíntesis ocurra es necesaria la absorción de la energía lumínica proveniente del Sol, de manera que es una reacción endotérmica.
Para que la fotosíntesis ocurra es necesaria la absorción de la energía lumínica proveniente del Sol, de manera que es una reacción endotérmica.
 Cuando ocurre una combustión
Cuando ocurre una combustión Tipos de reacciones
Existen diversos tipos de reacciones, entre las más conocidas se encuentran:
- Reacciones de síntesis: son aquellas donde los reactivos se combinan para formar uno o más productos.
A + B → C
 El agua (H2O) se forma por la combinación de hidrogeno (H2)
El agua (H2O) se forma por la combinación de hidrogeno (H2) - Reacciones de descomposición: son reacciones donde se obtienen dos o más productos a partir de un solo reactivo.
A → B + C
- Reacciones de desplazamiento: en estas reacciones un reactivo desplaza a un elemento de otro compuesto.
A + BC → AB + C
Por ejemplo, si se coloca en un vaso precipitado una cinta de zinc (Zn) metálico y se le adiciona ácido clorhídrico (HCl) se producirá una reacción de desplazamiento. Donde el Zn metálico desplazará al hidrógeno del ácido para formar una sal llamada cloruro de zinc (ZnCl2).
2HCl + Zn → ZnCl2 + H2
La polimerización es tipo de reacción química en la cual los monómeros, que son moléculas iguales sencillas y de baja masa molar, se combinan para formar una molécula de gran tamaño: los polímeros.
Algunos de los polímeros más conocidos son:

Celulosa
Es un polímero que se encuentra en las plantas y con el cual se fabrica el papel.

Poliestireno
Es un polímero derivado del petróleo con el que se fabrican vasos, platos y envases desechables. En los países latinoamericanos se le conoce como telgopor o anime.
Reacciones de oxido – reducción: son aquellas en las que ocurre una transferencia de electrones, es decir, una sustancia gana electrones mientras otra los pierde.
A + B → A- + B+
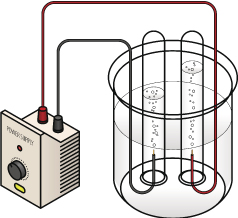 La electrólisis del agua (H2O) es una reacción de descomposición donde se obtienen hidrogeno (H2) y oxígeno (O2), según la reacción:
La electrólisis del agua (H2O) es una reacción de descomposición donde se obtienen hidrogeno (H2) y oxígeno (O2), según la reacción:Las reacciones químicas pueden ser reversibles o irreversibles. Esto dependerá de varios factores como el tipo de reacción y la naturaleza de los reactivos y productos.

La cal utilizada en la construcción se produce a partir de una reacción de descomposición térmica irreversible.

Las pilas recargables deben su funcionamiento a una reacción de oxido - reducción reversible.

