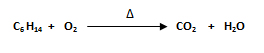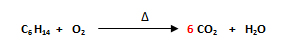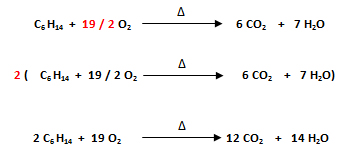Balanceo por tanteo. Ejercicios. Parte III.
Pasos para realizar el balanceo por tanteo:
- Se comienza a balancear por el reactivo o producto que posea el mayor número de átomos, específicamente por el elemento que dentro de dicho compuesto tenga el mayor subíndice.
- Si existe un ión poliatómico, éste se balancea como si se tratara de un solo átomo.
- El hidrógeno y el oxígeno se balancean de últimos. Todos los coeficientes deben ser números enteros y no se deben alterar los subíndices.
Ejercicios:
1. Balancee la siguiente reacción:

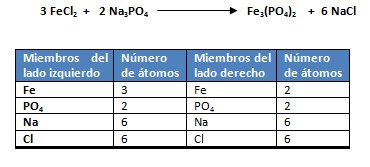
- El primer paso es seleccionar el compuesto que posea la mayor cantidad de átomos. El compuesto con mayor número de átomos es el fosfato de hierro Fe3(PO4)2.
- Se comienza balanceando al hierro (Fe), ya que es el que posee el mayor número de átomos. Como en el miembro del lado izquierdo hay 1Fe (FeCl2) y en el miembro del lado derecho hay 3Fe (Fe3(PO4)2) se escribe un 3 delante del Fe del miembro izquierdo.
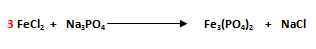
- Se balancea al ión poliatómico, el PO4-3. Recuerde que para su balanceo éste debe ser tratado como un solo átomo. En el miembro del lado izquierdo hay 1PO4 (Na3PO4) y en el miembro del lado derecho hay 2PO4 (Fe3(PO4)2), por lo que se escribe un 2 delante del Na3PO4.

- Se balancea al sodio (Na). Como en el miembro del lado izquierdo hay 6Na (2 Na3PO4) y en el miembro del lado derecho hay 1Na (NaCl) se escribe un 6 delante del Na del miembro derecho.
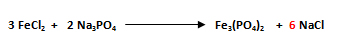
- Finalmente se balancea el cloro (Cl). En el miembro del lado izquierdo hay 6Cl (3 FeCl2) y en el miembro del lado derecho hay 6 Cl (6 NaCl), por lo que el cloro está balanceado. Se recuerda llevar el orden de los pasos al momento de balancear.

- Al verificar los coeficientes se observa que la ecuación química está balanceada:
2. Balancee la siguiente reacción:
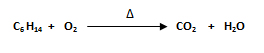
- El primer paso es seleccionar el compuesto que posea la mayor cantidad de átomos. El compuesto con mayor número de átomos es el hidruro de carbono C6H14.
- Se comienza balanceando al carbono (C), ya que es el que posee el mayor número de átomos. Se recuerda que el hidrógeno se balancea de último. Como en el miembro del lado izquierdo hay 6C (C6 H14) y en el miembro del lado derecho hay 1C (CO2) se escribe un 6 delante del C del miembro derecho.
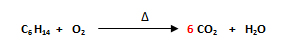
- Se balancea al hidrógeno (H). En el miembro del lado izquierdo hay 14H (C6 H14) y en el miembro del lado derecho hay 2H (H2O), por lo que se escribe un número que multiplicado por 2 dé 14 delante del agua (H2O). El número es 7, ya que 2 x 7= 14.
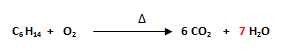
- Finalmente se balancea al oxígeno (O). En el miembro del lado izquierdo hay 2O (O2) y en los miembros del lado derecho hay 12 O (6 CO2) más 7O (7 H2O), que hacen un total de 19 O.
Se debe escribir la fracción 19/ 2 (el número más alto entre el número más bajo) en el O2 ya que 19/2 x 2= 19, y luego, dado a que solo se admiten números enteros en el balanceo de ecuaciones, se debe multiplicar a todos los coeficientes por 2.
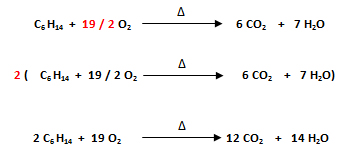
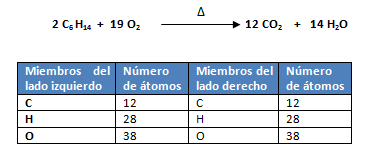
- Al verificar los coeficientes se observa que la ecuación química está balanceada:
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 72-76.
 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS