 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
COMPUESTOS DE COORDINACIÓN
Según Lewis, las definiciones para ácidos y bases son:
Un compuesto de coordinación o complejo es el resultado de la interacción de un átomo central, es decir, un ión metálico con orbitales de valencia vacíos que puede actuar como un ácido de Lewis, y una o varias bases de Lewis con pares de electrones libres, conocidas como ligandos o agentes acomplejantes. La interacción entre ambos compuestos conlleva a la formación de un enlace covalente coordinado o dativo.
Los metales de transición son los átomos que presentan mayor tendencia a disponer orbitales vacíos capaces de aceptar pares de electrones. Los ligandos coordinan al metal formando el complejo el cual puede ser neutro, catiónico o aniónico.
La carga del complejo será igual a la suma de las cargas del átomo metálico central y de los ligando que lo rodean. El número de coordinación (NC) es el número de átomos unidos a él.
TEORÍA DEL CAMPO CRISTALINO (TCC)
La teoría del campo cristalino (TCC) es un modelo principalmente electrostático que se utiliza en el estudio de enlaces de compuestos de coordinación, es decir, de cómo se forman los enlaces entre el átomo central y los ligandos.
La TCC fue inicialmente aplicada con el objetivo de explicar las formas geométricas, las propiedades magnéticas y el color de los compuestos de coordinación.
La TCC se basa en el campo eléctrico generado por los pares de electrones de los ligandos alrededor del metal. Linus Pauling desarrolló y extendió la idea de la donación de pares de electrones de los ligandos hacia los orbitales híbridos del átomo central, con sus consecuencias estereoquímicas, las cuales se pueden estudiar en la tabla 1. Con el propósito de comprender claramente las interacciones que tienen lugar en los complejos de los metales de transición, es conveniente recordar cómo se orientan espacialmente los orbitales “d” (Figura 1, sugerir imagen).
Tabla 1. Teoría de enlace de valencia (TEV) de Pauling.
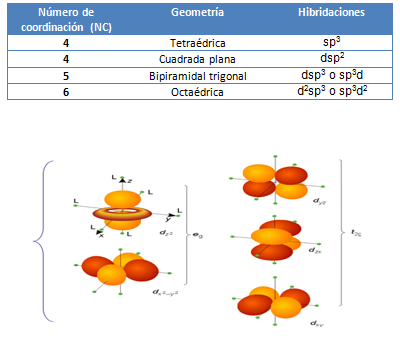
Figura 1. Orbitales “d”. Tomado de: Shriver & Atkins (1999).
La TCC estudia la influencia de la distribución espacial de los ligandos alrededor del átomo central sobre el desdoblamiento de los orbitales “d”.
Cuando los ligandos se acercan en las direcciones de los ejes X, Y y Z al átomo debido a la atracción entre las cargas negativas de los ligandos con la carga positiva del núcleo del átomo central, la energía de los orbitales “d” aumenta, ya que al mismo tiempo se produce una interacción de repulsión entre los electrones del átomo del metal y los electrones de los ligandos. No obstante, el aumento de energía no es de igual magnitud para los cinco orbitales “d”, ya que los que se encuentran situados sobre los ejes se repelen más fuertemente con los electrones de los ligandos (los dos orbitales ubicados a la izquierda en la figura 1) que los que se encuentran entre los ejes (los tres orbitales ubicados a la derecha en la figura 1).
Como consecuencia, los orbitales “d” se desdoblan energéticamente en dos conjuntos: el conjunto axial de orbitales (llamado eg, a la izquierda en la figura 1) aumenta su energía, ya que los electrones situados en estos orbitales interactúan repulsivamente y de modo directo con los electrones de los ligandos, mientras que el otro conjunto (llamado t2g, a la derecha en la figura 1) la disminuye con respecto a la energía promedio (la energía es conservativa, a medida que unos orbitales aumentan la energía, los restantes deben disminuirla). La diferencia de energía entre los orbitales eg y t2g se representa por el símbolo  c, y se denomina “energía de desdoblamiento del campo cristalino octaédrico”.
c, y se denomina “energía de desdoblamiento del campo cristalino octaédrico”.
Este proceso puede ser considerado por partes en un diagrama energético como el que se muestra en la figura 2. En ella cada guión representa un orbital “d” (también suelen utilizarse cuadritos para representar los orbitales). En el ión metálico libre todos tienen la misma energía y son indistinguibles entre sí, pero al acercarse gradualmente los ligandos se produce un incremento de la energía, que es la que tendría cada orbital si la distribución de cargas de los ligandos fuera de simetría esférica. Sin embargo, la distribución de cargas de los ligandos no es esférica, sino que está orientada en las direcciones de los ejes X, Y y Z.
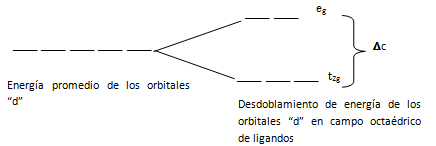
Figura 2.Efecto del campo octaédrico de ligandos sobre la energía de los orbitales “d” del átomo central.
Los factores que afectan la distribución espacial de los ligandos alrededor del átomo central sobre el desdoblamiento de los orbitales “d” son los siguientes:
 c aumenta a igualdad de geometría y de ligandos.
c aumenta a igualdad de geometría y de ligandos. 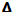 c disminuye al ir descendiendo de series. Para un mismo ligando, el valor de
c disminuye al ir descendiendo de series. Para un mismo ligando, el valor de 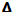 c cambia en el siguiente orden para los metales de la primera serie de transición:
c cambia en el siguiente orden para los metales de la primera serie de transición:Mn (II) < Ni(II) < Co(II) < Fe(II) < V(II) < Fe(III) < Cr(III) ~ V(III) < Co(III)
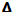 c aumenta al disminuir la electronegatividad del átomo donante del ligando en el siguiente orden:
c aumenta al disminuir la electronegatividad del átomo donante del ligando en el siguiente orden:I < Br < Cl < S < F < O < N < C
El número de ligandos y su disposición geométrica influyen en el valor de la energía de desdoblamiento.
Ejercicio:
1. Aplicar la teoría del campo cristalino (TCC) para el compuesto coordinado {Co F6}-3.
El compuesto tiene un número de coordinación “6”, es decir CN=6 dado a que están unidos seis ligandos al átomo metálico central, por lo que su geometría es octaédrica y su hibridación puede ser de dos tipos, d2sp3 o sp3d2 (véase la tabla 1).
Co+3= 3 d6
Se recuerda que la configuración electrónica del cobalto es:
Co= Z= 27
1S2
2S2 2P6
3S2 3p6 3d7
4S2
Si al cobalto le faltan 3 electrones (por lo tres átomos de flúor restantes), su configuración electrónica debe ser 3 d6
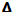 c y la energía de apareamiento de espín (Es). Dado a que el ligando, es débil (espín alto), la
c y la energía de apareamiento de espín (Es). Dado a que el ligando, es débil (espín alto), la  c es baja y los electrones ingresan primero en paralelos a todos los orbitales.
c es baja y los electrones ingresan primero en paralelos a todos los orbitales.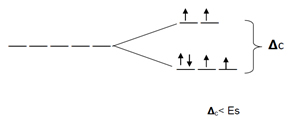
Para el caso de ligandos de mayor fortaleza, la  c es alta y la Es es baja (espín bajo) por lo que los electrones primero se aparean para luego ir a un nivel superior de energía.
c es alta y la Es es baja (espín bajo) por lo que los electrones primero se aparean para luego ir a un nivel superior de energía.
Se recuerda que para los orbitales “d” del átomo central:
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 195-201.
Shriver & Atkins (1999). Inorganic Chemistry-3rd Ed. Oxford Uiversity Press. Oxford.
Webmaster (2009). 1.5 teoría del campo cristalino. Facultad de Química. Universidad de La Habana. Cuba. Consulta en línea: http://www.fq.uh.cu/dpto/qi/images/stories/pog/pag/ino2/complejos/TCC1.htm.