 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Anteriormente se indicó que la expresión matemática para calcular la masa molecular relativa (Mr) y la masa molar (M) era:
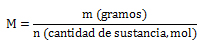
Esta fórmula se puede utilizar para el cálculo de la cantidad de sustancia, mol o número de moles, siempre y cuando se tenga la cantidad en gramos del elemento o molécula que se está estudiando, por lo que la masa atómica, masa molecular o masa molar se trabaja en las unidades gramos/mol (g/mol; g.mol-1). El despeje quedaría:
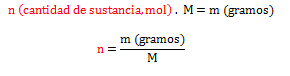
Cuando la masa del elemento o molécula es expresada en formas microscópicas (átomos, iones, electrones, protones, moléculas o partículas), se utiliza el número de Avogadro (L) equivalente a 6,02.1023. El cálculo de la cantidad de sustancia se realiza a través del despeje:
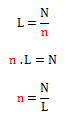
A continuación se estudiarán diferentes situaciones problemáticas para el cálculo de la cantidad de sustancia o mol de un elemento o molécula.
1. Calcular la cantidad de oro expresada en moles de átomos, correspondientes a 12 gramos de oro atómico.
g = 12 g de Au ; n = ¿?
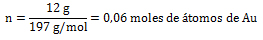
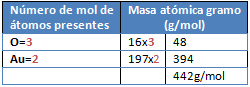
2. Calcular la cantidad de óxido de oro (III) expresada en moles de moléculas, que corresponde a 40 gramos de Au2O3.
g= 40 g de Au2O3 ; n= ¿?
M Au2O3: ¿?

3. Calcular la cantidad de hierro expresada en moles de átomos, que corresponde a 7, 23. 1022 átomos de Fe.
N= 7, 23. 1022 átomos de Fe; L= 6,02.1023 átomos; n= ¿?
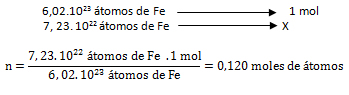
4. Calcular la cantidad de moléculas de glucosa contenidas en 0,8 moles de C6H12O6.
n= 0,8 moles de C6H12O6; L= 6,02.1023 moléculas; N: ¿?

Referencias bibliográficas
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 45-48.