 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Mediante experimentos se ha confirmado que el volumen que ocupa cualquier gas, indiferentemente de su naturaleza o composición, en condiciones normales de presión y temperatura (CNPT o CN), es de 22, 4 litros por mol de sustancia, siendo las condiciones normales de temperatura 0°C (273 K) y presión igual a 1 amt (760 mm de Hg). Este volumen es denominado volumen molar (VM).
Dado que en un mol de moléculas de cualquier sustancia en estado gaseoso hay 6,02. 1023 moléculas, quiere decir entonces que esa cantidad de moléculas está presente en un volumen de 22,4 L.
A continuación se estudiarán diferentes situaciones problemáticas para el cálculo del número de moles, la masa molar o el volumen inicial de una sustancia dada, partiendo del valor del volumen molar (VM).
Se recuerda que pueden utilizarse las fórmulas de masa molar, número de moles y número de Avogadro siempre y cuando se haga el correcto análisis del problema, sus correspondientes analogías y despejes de fórmulas:

1. Calcular el volumen inicial (Vo) que ocupa 3,23. 1022 moléculas de gas metano (CH4).
N=3,23. 1022 moléculas de CH4; L= 6,02. 1023 moléculas/mol; VM= 22,4 L/mol; Vo= ¿?


2. Calcular la cantidad de sustancia en moles de moléculas de cloro diatómico, contenidos en 4,35 L de Cl2 a CNTP.
Vo= 4,35 L de Cl2; VM= 22,4 L/mol; n= ¿?
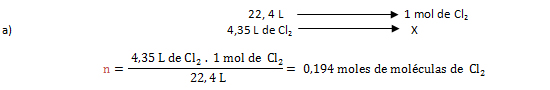
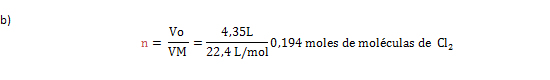
3. Calcular la masa molar (M) de 1, 35 gramos de gas oxígeno, ocupado en un volumen de 3,10 L en CNTP.
Vo= 3,10 L de O2; m= 1,35 g de de O2; VM= 22, 4 L/mol; M: ¿?
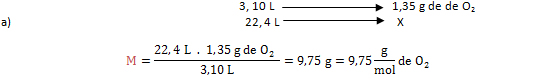
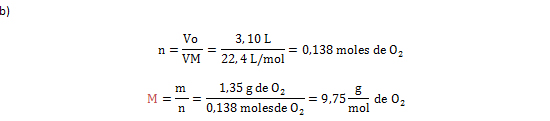
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 48-50.