 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
La fórmula porcentual, también conocida como composición centesimal o composición porcentual, representa la masa de cada elemento en gramos por cada 100 gramos del compuesto, es decir, las partes por cien de un compuesto. Por ejemplo, si en algún complejo vitamínico en polvo el 0,5% es de hierro (Fe), eso indica que por cada 100 gramos del complejo vitamínico, 0,5 gramos son de hierro.
La fórmula porcentual es un tipo de fórmula utilizada en la química analítica, específicamente en el análisis cualitativo y cuantitativo de los compuestos de los cuales se desconoce su naturaleza, esto se refiere a qué elementos forman parte de dicho compuesto y su proporción. La fórmula porcentual junto con la fórmula empírica y la fórmula molecular forman parte de las relaciones estequiométricas que se obtienen por análisis químicos.
Al determinar la fórmula porcentual de un compuesto se descubren los elementos que componen al compuesto, la masa de los elementos por cada 100 gramos y la proporción de dichas masas de elementos mezcladas. Se expresa matemáticamente bajo las fórmulas:

Siendo “X” cada uno de los compuesto que integran al compuesto. Las fórmulas son utilizadas en función a las unidades de masa de los elementos, en uma/mol (u/mol), gramos/mol (g/mol) o gramos (g).
Ejercicios:
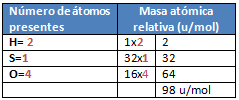
1. Calcular la fórmula porcentual del ácido sulfúrico H2SO4 y el hidróxido de calcio Ca(OH)2.
a) Compuesto= H2SO4, Ar (H) = ¿? , Ar (S) = ¿? , Ar (O) = ¿? ; % H= ¿? , % S = ¿? , % O = ¿?
b) Compuesto= Ca(OH)2, Ar (Ca) = ¿? , Ar (O) = ¿? , Ar (H) = ¿? ; % Ca= ¿? , % O = ¿? , % H = ¿?
a) Mr H2SO4= ¿?
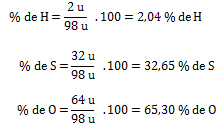
b) Mr Ca(OH)2= ¿?

2. Calcular la fórmula porcentual de 10 gramos de acero (aleación de hierro y carbono), el cual posee 0,05 gramos de carbono y 9,95 gramos de hierro.
Acero= 10 g, masaC = 0,05 g, masaFe = 9,95 g; % C = ¿? , % Fe = ¿?
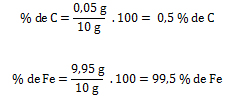
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 52-53.