 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS




Es una rama de la física que estudia los efectos de los cambios de la temperatura, presión y volumen de los sistemas físicos a un nivel macroscópico. Es decir, se interesa por la circulación de la energía y cómo ésta infunde movimiento.
Conceptos fundamentales

El Sol constituye una importante fuente de energía para nuestro planeta.
La termodinámica se comenzó a desarrollar en el siglo XIX con el objetivo de mejorar el rendimiento de las primeras máquinas térmicas fabricadas durante la Revolución Industrial.
Existen leyes de la Termodinámica que definen cómo tienen lugar las transformaciones de energía. Antes de adentrarnos en sus postulados vamos a definir algunos conceptos.
Sistema termodinámico: es el cuerpo o conjunto de cuerpos sobre el que tiene lugar una transformación termodinámica. Por ejemplo: vapor de una máquina, una célula, la atmósfera terrestre, etc.
Para estudiar un sistema se parte de su estado, es decir, de sus características físicas en un instante determinado. Para ello se tienen en cuenta datos sobre la masa, presión, temperatura, etc. que son medibles. A nivel microscópico se estudian las partículas (moléculas, átomos), sus posiciones y velocidades. En este último examen se pueden observar las propiedades macroscópicas.
Los sistemas termodinámicos pueden ser aislados, cerrados o abiertos.
* Sistema aislado: es aquél que no intercambia ni materia ni energía con los alrededores.
* Sistema cerrado: es aquél que intercambia energía (calor y trabajo) pero no materia con los alrededores (su masa permanece constante).
* Sistema abierto: es aquél que intercambia energía y materia con los alrededores.
Calor: es la TRANSMISIÓN de energía de un cuerpo a otro.

El movimiento de los átomos y moléculas está relacionado con el calor o energía térmica. Al calentar una sustancia aumenta la velocidad de las partículas que la forman.
El calor tiene la capacidad de fluir entre dos cuerpos, siempre y cuando se encuentren a diferente temperatura. La transmisión de calor ocurre desde el cuerpo más caliente al más frío. El cuerpo que recibe calor aumenta su temperatura y el que cede calor la disminuye.
Antes de ser transferida, la energía que está dentro de los límites del sistema no es calor, sino energía interna o energía total disponible. Hay que tener en cuenta que se habla de calor solo cuando hay transmisión de energía.
Una vez que un sistema absorbe la energía transferida en forma de calor, esta última deja de ser calor y se transforma en energía interna del sistema, es decir, deja de ser calor porque ya no está en tránsito entre dos sistemas con diferentes temperaturas.
Luego de una transferencia de energía (calor) es erróneo decir que un cuerpo almacenó calor, lo que almacenó es energía luego de dicha transferencia. Se conoce con el nombre de energía térmica a la energía interna del sistema; es decir, a la que se encuentra almacenada.
Temperatura: es la medida de la energía térmica de una sustancia. Se mide con un termómetro. Las escalas más empleadas para medir esta magnitud son la Escala Celsius (o centígrada) y la Escala Kelvin. 1ºC es lo mismo que 1 K, la única diferencia es que el 0 en la escala Kelvin está a - 273 ºC.
Equilibrio termodinámico: cuando hay un equilibrio térmico, mecánico y químico.
El equilibrio térmico se da cuando todas las partes o cuerpos que forman el sistema se encuentran a la misma temperatura, el equilibrio químico se da si en su interior no se produce ninguna reacción química y el equilibrio mecánico se da cuando la resultante de las fuerzas que actúan sobre él es nula. Entonces cuando se cumplen esas tres condiciones de equilibrio se puede decir que existe equilibrio termodinámico.
Por lo tanto, hay que tener en cuenta que si un sistema no se halla en equilibrio termodinámico tenderá de modo espontáneo y con independencia de cualquier acción externa hacia un estado en que este equilibrio sea satisfecho.
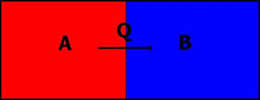
Se llama calor (Q) a la energía que se transfiere de un objeto a otro debido a una diferencia de temperatura. Si se dejan en contacto cierto tiempo ambos cuerpos, alcanzarán la misma temperatura.
Ecuación de estado: es una ecuación que relaciona, para un sistema en equilibrio termodinámico, las variables de estado que lo describen. Por ejemplo, las variables de un gas sería: masa, presión, volumen y temperatura.
La ecuación de estado es característica de cada sustancia y para los líquidos no se dispone de una expresión en términos generales que describa esa relación.
Para el caso particular del agua se conoce que su densidad en estado líquido crece desde 0º C hasta 4º C y desde allí disminuye hasta 100º C. Con respecto a los gases, la ecuación de estado solo está establecida para los gases ideales.
Transformación termodinámica: cuando un sistema pasa de un estado de equilibrio termodinámico a otro se dice que experimenta una transformación termodinámica.

Durante una transformación termodinámica no hay equilibrio y no se puede aplicar ninguna ecuación de estado. Durante la transformación podemos detectar diferentes estados de equilibrio, a su vez las transformaciones se pueden dar de diferentes modos:
Cuasi-estático: es un proceso que tiene lugar de forma infinitamente lenta. Generalmente este hecho implica que el sistema pasa por sucesivos estados de equilibrio, en cuyo caso la transformación es también reversible.
Reversible: es un proceso que, una vez que ha tenido lugar, puede ser invertido sin causar cambios ni en el sistema ni en sus alrededores.
Irreversible: es un proceso que no es reversible. Los estados intermedios de la transformación no son de equilibrio.
Leyes de la termodinámica
Ley Cero o de equilibrio térmico
La ley postula que los sistemas equilibrados tienen la misma temperatura. Dice: “dos sistemas en equilibrio térmico con un tercero, están en equilibrio térmico entre sí”.
El contenido de esta ley ha sido útil para definir la temperatura como una propiedad termodinámica y no en función de las propiedades de una sustancia. Podemos ver la aplicación de esta ley en el funcionamiento de un termómetro de vidrio porque este instrumento constituye un excelente método para medir la temperatura corporal, por ejemplo.

La aplicación de esta ley significa un método para medir la temperatura de cualquier sistema escogiendo una propiedad del mismo que varíe con la temperatura con suficiente rapidez y que sea de fácil medición, llamada propiedad termométrica.
En el caso del termómetro, el mercurio en el capilar de vidrio cumple la función de ser sistema que indica la variación de la temperatura debido a la expansión térmica que sufre el mercurio ante la presencia de energía. Cuando se alcanza el equilibrio térmico, ambos sistemas tienen la misma temperatura, en este caso sería el cuerpo y el termómetro.
Primera Ley
Esta ley es también conocida como principio de conservación de la energía y postula que “la energía no puede ser creada ni destruida, solo puede transformarse de un tipo de energía en otro”.
De este modo se define al calor como una forma de energía que puede almacenarse pero que no es una sustancia material.
Segunda Ley
De acuerdo a la segunda ley “solamente se puede realizar un trabajo mediante el paso del calor de un cuerpo con mayor temperatura a uno que tiene menor temperatura”. La energía de los cuerpos con mayor temperatura pasa de modo espontáneo al de menor temperatura.
Tercera Ley
La última ley postula “que el cero absoluto no puede alcanzarse por ningún procedimiento que conste de un número finito de pasos. Es posible acercarse indefinidamente al cero absoluto, pero nunca se puede llegar a él".