 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
La fórmula molecular, también conocida como fórmula verdadera, representa la composición real de un compuesto ya que señala la proporción real de moles de átomos de cada elemento que integra al compuesto estudiado. Esta fórmula forma parte de las relaciones estequiométricas que se generan de análisis químico de compuestos de naturaleza desconocida.
La fórmula molecular en muchos compuestos coincide con la fórmula empírica ya que es un múltiplo de ésta. Ejemplo de ellos son las fórmulas moleculares y empíricas del agua (H2O), el metano (CH4), entre otros.
Para determinar la fórmula molecular de un compuesto se necesita conocer su fórmula empírica, es decir, su fórmula porcentual o masas de los elementos expresadas en gramos más sus masas atómicas relativas, y la masa molar del compuesto estudiado.
La fórmula molecular puede calcularse de dos maneras:

Siendo “X” el factor (número de moles) por el cual se multiplica a la fórmula empírica, es decir, a cada uno de los subíndices de los elementos que la forman. Las fórmulas son utilizadas en función a las unidades de masa de los elementos, en gramos/mol (g/mol) o gramos (g).
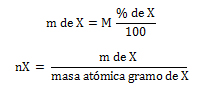
Siendo “nX” el número de moles de átomos de cada uno de los elementos del compuesto y “X” cada uno de los elementos que integran al compuesto. Las fórmulas son utilizadas en función a las unidades de masa de los elementos, en gramos/mol (g/mol) o gramos (g).
Ejercicios:
1. Calcular la fórmula empírica y la fórmula molecular para la estrona (una hormona sexual femenina) cuya masa molar es de 270 g/mol y su fórmula porcentual es:
Compuesto estrona= C = 80 %, H = 8,2 %, y O = 11,8 %.
Compuesto estrona= Ar (C) = ¿? , Ar (H) = ¿? , Ar (O) = ¿? ; C = 80 %, H = 8,2 %, y O = 11,8 %.
Masa molar de la estrona= 270 g/mol; Fórmula empírica estrona= ¿? ; Fórmula molecular estrona = ¿?
Compuesto estrona =


Procedimiento 1:

fórmula molecular =2 (C9 H11 O1 )= C18 H22 O2
Los elementos se combinan en una proporción real de 18 moles de átomos (o átomos) de carbono C, 22 moles de átomos de hidrógeno H y 2 mol de átomos de oxígeno O.
Procedimiento 2:
Carbono (C)
1. Cálculo=
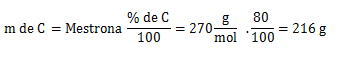
2. Cálculo=
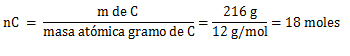
Hidrógeno (H)
1. Cálculo=
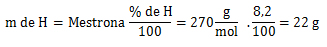
2. Cálculo=
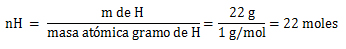
Oxígeno (O)
1. Cálculo=
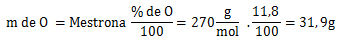
2. Cálculo=
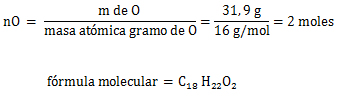
Los elementos se combinan en una proporción real de 18 moles de átomos (o átomos) de carbono C, 22 moles de átomos de hidrógeno H y 2 mol de átomos de oxígeno O.
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 58-64.