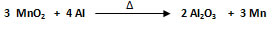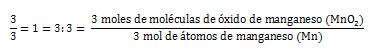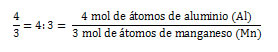Relaciones estequiométricas y cálculos estequiométricos. Parte I
Relaciones estequiométricas:
Las relaciones cuantitativas de los compuestos y elementos en una reacción química son estudiadas a través de la estequiometría.
La estequiometría permite interpretar una ecuación química en dos niveles, un nivel atómico-molecular y un nivel molar. Se estudiarán ambas interpretaciones en función a la siguiente ecuación química balanceada:
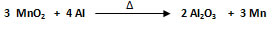
- Interpretación atómico-molecular. Cuantitativamente la ecuación se lee: 3 moléculas de óxido de manganeso reaccionan con 4 átomos de aluminio para producir 2 moléculas de óxido de aluminio y 3 átomos de manganeso.
- Interpretación molar- Cuantitativamente la ecuación se lee: 3 moles de moléculas de óxido de manganeso reaccionan con 4 mol de átomos de aluminio para producir 2 moles de moléculas de óxido de aluminio y 3 mol de átomos de manganeso.
De ambas interpretaciones se tienen las siguientes relaciones estequiométricas:
- Relación de combinación entre el óxido de manganeso y aluminio:

- Relación entre la proporción de óxido de manganeso y manganeso producido:
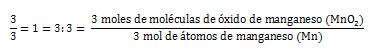
- Relación entre las proporciones de óxido de aluminio y manganeso producidos:

- Relación entre la proporción de aluminio reactante y el manganeso producido:
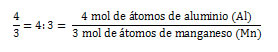
Estas relaciones permiten conocer la cantidad de moles de moléculas o mol de átomos de un compuesto o elemento, respectivamente, necesaria para hacer reaccionar una determinada cantidad de moles de moléculas o mol de átomos de otro compuesto o elemento. Por ejemplo, las relaciones anteriores permiten conocer la cantidad en moles de moléculas de óxido de manganeso necesaria para hacer reaccionar a 8 mol de átomos de aluminio. El cálculo se realiza de la siguiente forma:

Cálculos estequiométricos
Los cálculos estequiométricos indican las relaciones numéricas y procedimientos matemáticos que se desprenden de una ecuación química.
Ellos son:
- Rendimiento: cantidad de sustancia obtenida (producto) en función a la cantidad de los reactivos. El rendimiento estequiométrico se obtiene cuando uno de los reactivos se agota sin pérdida de productos.
- Reactivo limitante: reactivo que limita la cantidad de producto que se obtiene en la reacción.
- Pureza del compuesto: cantidad de compuesto puro (en porcentaje) que existe en una muestra.
Dentro de los cálculos estequiométricos se conocen diferentes métodos para resolver los problemas de estequiometría en donde el método molar es el más utilizado. El método molar se basa en una serie de pasos para resolver los problemas según los datos que se faciliten:
- El primer paso es balancear la ecuación química.
- El segundo paso es calcular la cantidad de sustancia (mol) del compuesto conocido, cuya masa está expresada en gramos. Se utiliza la siguiente fórmula:

- El tercer paso es calcular la cantidad de sustancia (mol) del compuesto desconocido, a partir de los coeficientes de la ecuación.
- El cuarto paso es calcular la masa o el volumen de la sustancia desconocida a partir del tercer paso.
Los problemas estequiométricos se clasifican según las siguientes relaciones:
- Problema número de moles- número de moles (n-n).
- Problema masa-masa (m-m).
- Problema masa-volumen (m-v).
- Problema volumen-volumen (v-v).
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 76-99.
 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS