 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
El método molar se basa en una serie de pasos para resolver los problemas estequiométricos según los datos que se faciliten:

Los problemas estequiométricos se clasifican según las siguientes relaciones:
A continuación se estudiarán los problemas tipo m-m, es decir, masa-masa. Estos problemas pueden ser de dos tipos, problemas con sustancias puras o problemas con sustancias impuras (se debe calcular el porcentaje de pureza). Tanto la sustancia conocida como la desconocida están en unidades de masa, en gramos.
Ejercicios:
2. Al calentar el óxido de mercurio HgO se descompone en mercurio elemental Hg y oxígeno molecular O2. Calcular la cantidad de HgO en gramos que se necesita para descomponer 20 gramos de O2 y su rendimiento teórico.
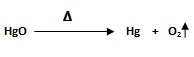
mHgO= ¿? ; mO2 = 20 gramos; rendimiento teórico= ¿?

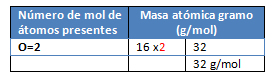
M= O2
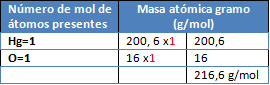
M= HgO
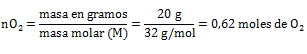

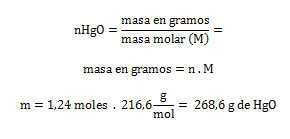
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 76-99.