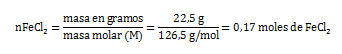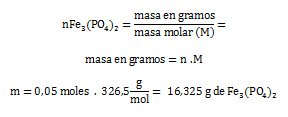Cálculos estequiométricos. Ejercicios. Parte IV
El método molar se basa en una serie de pasos para resolver los problemas estequiométricos según los datos que se faciliten:
- El primer paso es balancear la ecuación química.
- El segundo paso es calcular la cantidad de sustancia (mol) del compuesto conocido, cuya masa está expresada en gramos. Se utiliza la siguiente fórmula:

- El tercer paso es calcular la cantidad de sustancia (mol) del compuesto desconocido, a partir de los coeficientes de la ecuación.
- El cuarto paso es calcular la masa o el volumen de la sustancia desconocida a partir del tercer paso.
Los problemas estequiométricos se clasifican según las siguientes relaciones:
- Problema número de moles- número de moles (n-n).
- Problema masa-masa (m-m).
- Problema masa-volumen (m-v).
- Problema volumen-volumen (v-v).
A continuación se estudiarán los problemas tipo m-m, es decir masa-masa, con sustancias impuras (se debe calcular el porcentaje de pureza). Tanto la sustancia conocida como la desconocida están en unidades de masa, en gramos.
Una muestra de cloruro de sodio (NaCl) que posee un porcentaje de pureza de 85 % quiere decir que contiene 85 unidades de masa de NaCl puras y 15 unidades de masa impuras.
Ejercicios:
- Sustancias impuras reaccionantes, tanto por ciento de pureza (% de pureza):
1. Calcular la cantidad en gramos de fosfato de hierro (Fe3(PO4)2) que se producirán al hacer reaccionar 25 gramos de cloruro de hierro (FeCl2) al 90 % de pureza con suficiente fosfato de sodio (Na3PO4) y su rendimiento teórico.
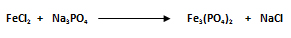
- El primer paso es escribir los datos:
mFe3(PO4)2 = ¿? ; m FeCl2 = 25 gramos ; % de pureza= 90 % ; rendimiento teórico= ¿?
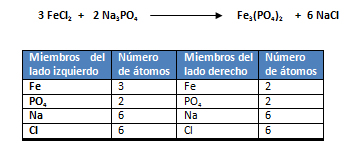
- El segundo paso es balancear la ecuación. Se selecciona el compuesto que posea la mayor cantidad de átomos. El compuesto con mayor número de átomos es el fosfato de hierro Fe3(PO4)2. Se balancea al hierro (Fe), ya que es el que posee el mayor número de átomos. Posteriormente al ión poliatómico, el PO4-3, luego al sodio (Na) y por último al cloro (Cl). La ecuación balanceada queda:
- El tercer paso es calcular la masa molar de la sustancia conocida y desconocida:
M= FeCl2
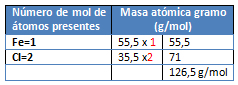
M= Fe3(PO4)2
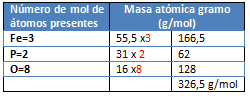
- Se determina la masa pura del FeCl2 reaccionante:

- Se calcula la cantidad de sustancia del FeCl2 a partir de la fórmula de n.
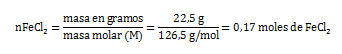
- Se determina la cantidad de sustancia de Fe3(PO4)2 a partir de los coeficientes de la ecuación. El análisis es:

- Por último se halla la masa del fosfato de hierro. Se realiza el despeje de la masa “m” de la fórmula de n.
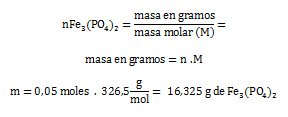
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 76-99.
 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS