 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS



La ciencia ha conseguido desarrollar productos que no solo nos han facilitado las tareas diarias sino que también nos han permitido gozar de un mayor confort. Porque el jabón, el champú, el alcohol en gel, la pasta dental y otros elementos no siempre existieron con las características y/o virtudes que tienen hoy en día. Veamos cómo contribuyó la química en este aspecto.
El jabón y champú
A diario utilizamos diversos productos para el aseo personal, sin embargo en pocas oportunidades nos preguntamos con qué elementos se fabrican. Empecemos por el jabón, un producto antiquísimo que antes del desarrollo de la química se lo fabricaba con agua, sebo y cenizas. Actualmente, este producto se obtiene a partir de una reacción química denominada saponificación o desdoblamiento hidrolítico. La misma se da entre una base (hidróxido de sodio o potasio) y un ácido graso (manteca de cerdo, aceite de coco, grasas vegetales, etc.).

La reacción típica es:
ÁCIDOS GRASOS + SOLUCIÓN ALCALINA = JABÓN + GLICERINA
La grasa, al ser insoluble en el agua, no se puede eliminar utilizando solo este líquido. Es por ello que se añade jabón, el cual es soluble en ambos, y permite que se diluya la grasa. El movimiento durante el proceso de lavado y el agua caliente favorecen el desprendimiento de las partículas de grasa.

Otro producto empleado en el aseo personal es el champú, el cual cumple la función de limpiar quitando la grasa -producida por las glándulas sebáceas-, las escamas de la piel y, en general, las partículas contaminantes.
La grasa secretada por las glándulas sebáceas, denominada sebo, es absorbida por el cabello protegiéndolo de daños externos. Sin embargo, también contribuye a que la suciedad del ambiente quede atrapada allí. Es por ello que los champús apartan el sebo de modo equilibrado para generar una acción limpiadora pero también protectora.

El champú actúa con el mismo principio que lo hace el jabón. Como dijimos anteriormente, la grasa no es arrastrada por el agua; en consecuencia no se puede lavar el cabello solo con agua. Los surfactantes aniónicos que contienen los champús reducen la tensión de superficie del agua y favorecen la separación del sebo del cabello.
Así, tanto el jabón como el champú y los detergentes consiguen eliminar las grasas, los surfactantes o tensoactivos que contienen. ¿Qué son? Antes de responder esta pregunta debemos saber qué es la tensión superficial del agua.
La tensión superficial y las sustancias tensoactivas

La tensión superficial del agua, es el efecto físico que "endurece" la capa superficial del agua en reposo y permite a algunos insectos que se desplacen sin hundirse. Este fenómeno es causado por los efectos de las fuerzas intermoleculares que existen en la interfase.
Los jabones, los detergentes y los champús, entre otros, reducen la tensión superficial del agua gracias a sus sustancias tensoactivas. De este modo, los productos pueden cumplir con su función, por ejemplo limpieza.
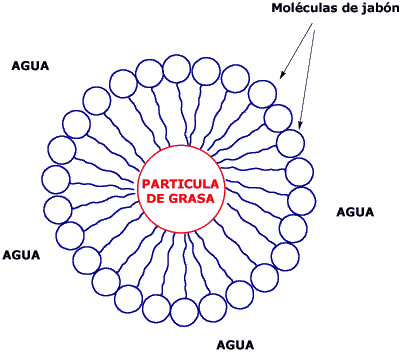
Los tensoactivos, también denominados surfactantes, son moléculas largas. Tienen carácter anfifílico, es decir, cada extremo se comporta de manera distinta; una punta de la molécula es soluble en agua -denominada hidrófila- y la otra es soluble en grasas -denominada hidrófoba-.
Gracias a esta "doble personalidad", las moléculas se organizan en presencia de grasas y agua formando una estructura en forma de burbuja que se llama micela. La parte hidrófila se sitúa hacia el exterior de la esfera, interaccionando con el agua; mientras que la parte hidrófoba se orienta hacia el centro de la esfera atrapando la grasa. Este mecanismo es el que permite que los productos de limpieza puedan cumplir su objetivo.
El pH del cabello y la piel
Con respecto a las cremas, jabones y productos para el cabello, un aspecto a tener en cuenta es su nivel de pH. ¿De qué se trata? El pH es una medida de acidez o alcalinidad de una disolución. La escala pH está dividida en 14 unidades, del 0 (la acidez máxima) al 14 (nivel básico máximo). El número 7 representa el nivel medio de la escala, y corresponde al punto neutro. Los valores menores que 7 indican que la muestra es ácida. Los valores mayores que 7 indican que la muestra es básica.
La mayoría de los champús que se pueden encontrar en el mercado tienen un pH que va de 6 a 8, es decir son ligeramente ácidos o casi neutros, y son los más recomendados para uso diario. Los champús muy alcalinos, con un pH superior a 8, hacen mucha espuma y son más efectivos porque producen la apertura de la cutícula del pelo permitiendo que éste se limpie con mayor profundidad. Sin embargo, también puede generar daño si se utilizan los productos alcalinos de modo frecuente.
La piel tiene un pH de 7, marcado como el pH-neutro al nacer, y entre 5.5 y 6 en la edad adulta. Por ello los componentes que se emplean para la higiene, especialmente los jabonosos suelen contener un pH de 7.5 a 8, así con su aplicación el pH de la piel asciende a un nivel neutro o casi neutro de 7 y 7.5.
Alcohol en gel
Actualmente muchas personas han adquirido la costumbre de llevar alcohol en gel en sus bolsos para poder higienizar sus manos cuando no cuentan con jabón y agua a su alcance.
Los alcoholes en gel tienen una cantidad de alcohol en su composición de 65% a 75%, este porcentaje es suficiente para matar el 99,9% de las bacterias y los virus de las manos en 30 segundos. Para transformar el alcohol líquido en gel se le añade un compuesto gelificante, y para evitar que reseque la piel se le añaden productos humectantes.
Las sustancias empleadas en la mayoría de los geles sanitizantes son alcohol isopropílico, etílico o propílico. Sin embargo, también existen geles desinfectantes sin alcohol, con cloruro de benzalconio y triclosán.
Peróxido de hidrógeno
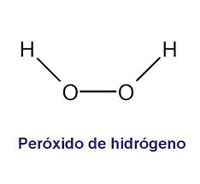
Más conocido como agua oxigenada, el peróxido de hidrógeno (H2O2) es un compuesto químico que tiene una molécula de oxígeno más que el agua. Fue descubierto en 1818 por Thénard y se desarrolló en la década de 1920 por científicos, con el objetivo de contener problemas de infecciones y gangrena en los soldados en el frente de batalla.
Cuando produce la efervescencia se libera el oxígeno de la fórmula y destruye los microorganismos anaerobios, siendo por lo tanto un potente desinfectante.
Algunos de sus usos son:
- Higiene de heridas e infecciones.
- Cuidado de la piel.
- Limpieza y desinfección hogareña.
Los dentífricos y enjuagues bucales

Un elemento químico importante en la higiene de los dientes es el flúor, que en su forma de fluoruro contribuye a mejorar la calidad del esmalte dental, consiguiendo que los dientes sean más resistentes a las caries. Además previene la multiplicación de bacterias en la boca.
No solo se encuentra en este tipo de productos sino también en algunos alimentos como el pescado azul, en algunas verduras como el repollo y las espinacas; en cereales como el trigo y el arroz; en frutas como las uvas y en el té.
Sin embargo, un exceso de flúor puede producir fluorosis dental (debilidad y manchado de los dientes). La concentración del ión fluoruro en la mayoría de los dentífricos es de 0,1%, y puede presentarse en forma de diferentes compuestos: monofluorfosfato de sodio (MFP), fluoruro de sodio y aminofloruros. De acuerdo con muchos estudios clínicos, los dentífricos con fluoruro de sodio son los que presentan mayor valor preventivo.
Flúor
Es el elemento químico de número atómico 9 situado en el grupo de los halógenos (grupo 17) de la tabla periódica de los elementos. Su símbolo es F.
A temperatura ambiente es un gas de color amarillo pálido. Es el elemento más electronegativo y reactivo.