 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
En química, cuando en una reacción no se describen las masas de los reaccionantes con su relación estequiométrica, se necesita establecer cuál es el reactivo limitante y ejecutar todos los cálculos en función a él. Ahora bien, ¿qué significa el término “reactivo limitante”?
El reactivo limitante se explica con un simple ejemplo basado en una solución con agua y limón, y aparte turrones o cubos de azúcar para formar un producto final llamado limonada. Se tienen tres vasos con la solución de agua y limón que necesitan ser endulzados cada uno con un turrón o cubo de azúcar, de los cuales hay dos. Es decir, que solo se puede obtener la limonada en dos vasos, ya que solo hay dos turrones por lo que el máximo de limonada generada está limitado por el número de turrones de azúcar. Al consumirse el número de turrones de azúcar, se detiene la formación de limonada y queda en exceso un vaso con solución de agua y limón. Los turrones de azúcar son nuestro reactivo limitante.
En las reacciones químicas sucede lo mismo que en el ejemplo anterior, los reactivos pueden estar limitados o en exceso, es decir, que sus cantidades estequiométricas no son precisas. Al consumirse el reactivo limitante o reactivo que esté en menor cantidad, la reacción química por consiguiente se detiene, por lo que la cantidad de producto generado depende de dicho reactivo y de allí su nombre.
El reactivo limitante se determina al identificar cuál de los reaccionantes es el que crea la menor cantidad de producto, en moles (cantidad de sustancia), gramos (masa) o litros (volumen). Obsérvese la siguiente reacción:

1mol de N2 reacciona con 3mol de H2 para producir 2mol de NH3. Como se observa en la ecuación química, sin importar la cantidad de moles de H2 presentes el número de moles de N2 limita la cantidad de NH3 que pueda producirse. El N2 es el reactivo limitante y el H2 el reactivo en exceso.
A continuación se estudiarán los problemas referentes al cálculo del reactivo limitante y el reactivo en exceso.
Ejercicios:
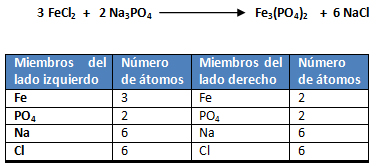
1. En la siguiente reacción química se hacen reaccionar 6 gramos de FeCl2 con 4 gramos de Na3PO4.

- Determinar:
a.- ¿Cuál es el reactivo limitante?
b.- La masa en gramos de NaCl que se forma.
c.- El rendimiento teórico de la reacción.
mFeCl2= 6 gramos; m Na3PO4= 4 gramos; reactivo limitante= ¿?; mNaCl= ¿? ; rendimiento teórico= ¿?; n reactivo en exceso=¿?.
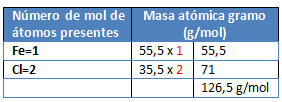
M= FeCl2
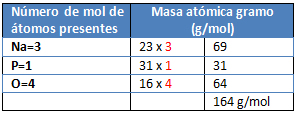
M= Na3PO4
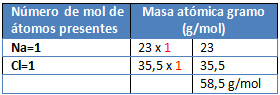
M= NaCl
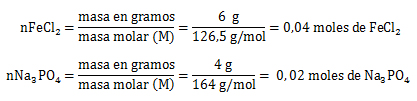
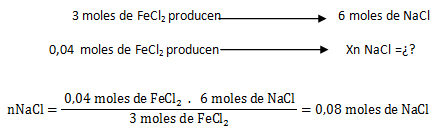
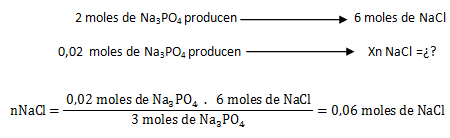
El reactivo limitante es aquél que origina la menor cantidad de moles de producto, o sea que el Na3 PO4 es el reactivo limitante y el FeCl2 el reactivo en exceso.

Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 76-99.