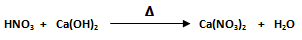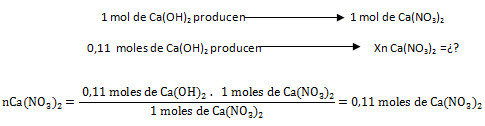Cálculos estequiométricos. Reactivo limitante. Ejercicios
A continuación se estudiarán los problemas referentes al cálculo del reactivo limitante y el reactivo en exceso.
Ejercicios:
1. En la siguiente reacción química se hacen reaccionar 18,9 gramos de HNO3 con 8,53 gramos de Ca(OH)2.
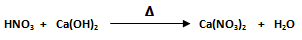
-Determinar:
a.- ¿Cuál es el reactivo limitante?
b.- La masa en gramos de Ca(NO3)2 que se forma.
c.- El rendimiento teórico de la reacción.
- El primer paso es escribir los datos:
mHNO3= 18,9 gramos; m Ca(OH)2= 8,53 gramos; reactivo limitante= ¿?; m Ca(NO3)2= ¿? ; rendimiento teórico= ¿?; n reactivo en exceso=¿?.
- El segundo paso es balancear la ecuación. Se selecciona el compuesto que posea la mayor cantidad de átomos. El compuesto con mayor número de átomos es el fosfato de hierro Ca(NO3)2. Se balancea al ión poliatómico, el NO3-, ya que es el que posee el mayor número de átomos. Posteriormente al calcio (Ca), luego al hidrógeno (H) y por último al oxígeno (O). La ecuación balanceada queda:

- El tercer paso es calcular las masa molares de las sustancias conocidas y de la sustancia desconocida:
M= HNO3
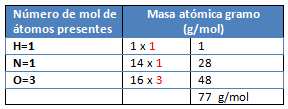
M= Ca(OH)2
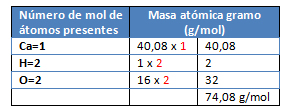
M= Ca(NO3)2
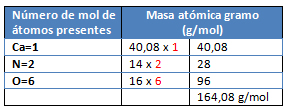
- Se procede a calcular los moles de las sustancias conocidas:

- Se determina el reactivo limitante calculando los moles de Ca(NO3)2 con los moles de cada reactivo y los coeficientes que poseen en la ecuación química balanceada:
- Con el HNO3:
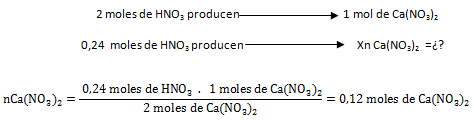
- Con el Ca(OH)2:
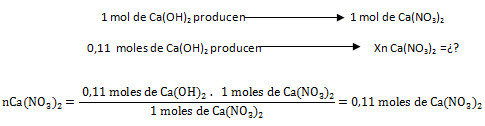
El reactivo limitante es aquél que origina la menor cantidad de moles de producto, o sea que el Ca(OH)2 es el reactivo limitante y el HNO3 el reactivo en exceso.
- Para calcular la masa del producto se toman los 0,11 moles formados. Recuérdese que el reactivo limitante detiene la reacción, por lo que se toman lo moles generados a partir de este.

Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 76-99.
 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS