 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Frecuentemente las reacciones químicas no se dan de forma completa, es decir, que los rendimientos calculados teóricamente no son reales.
Existe el rendimiento teórico, el cual se obtiene de los cálculos o relaciones estequiométricas, definido como la cantidad de producto formado una vez que el reactivo limitante se agota. No hay pérdida del producto cuando se realiza su aislamiento y posterior purificación. El rendimiento teórico corresponde a un rendimiento en donde la reacción está al 100 % de eficiencia.
El rendimiento práctico, real o experimental es aquel que indica la cantidad de producto que se obtiene experimentalmente, tomando en cuenta la formación de productos secundarios en la reacción, la pérdida de material durante su aislamiento y purificación debido al transvase de un recipiente a otro, errores en los equipos y materiales utilizados así como del experimentador. Es por ello que el rendimiento práctico siempre será menor al rendimiento teórico. El rendimiento práctico corresponde a un rendimiento en donde la reacción no está al 100 % de eficiencia.
El porcentaje de rendimiento de una reacción está dado por la expresión matemática:
El conocimiento de ambos rendimientos, y del hecho de que el rendimiento práctico esté muy próximo al teórico, es de gran importancia a nivel industrial. Para ello se emplean reactivos con la mayor pureza posible, es decir, que a mayor pureza de los reactantes mayor será su rendimiento.
A continuación se estudiarán los problemas referentes al cálculo del reactivo limitante, rendimiento teórico, rendimiento práctico y porcentaje de rendimiento de la reacción.
Ejercicios:
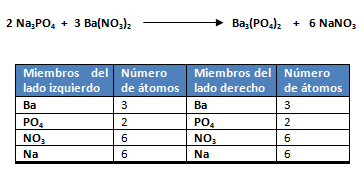
1. En la siguiente reacción química se hacen reaccionar 3,5 gramos de Na3PO4 con 6,4 gramos de Ba(NO3)2.

- Si el rendimiento real de NaNO3 es de 2,3 gramos, determinar:
a.- ¿Cuál es el reactivo limitante?
b.- La masa en gramos de NaNO3 que se forma.
c.- El rendimiento teórico de la reacción.
d.- El % de rendimiento de la reacción.
mNa3PO4 = 3,5 gramos; mBa(NO3)2= 6,4 gramos; Rendimiento práctico =2,3 gramos de NaNO3; reactivo limitante = ¿?; mNaNO3= ¿? ; Rendimiento teórico= ¿?; % de rendimiento de la reacción= ¿?.
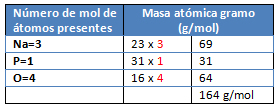
M= Na3PO4
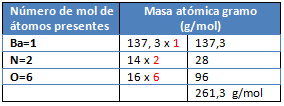
M= Ba(NO3)2
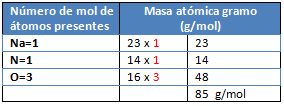
M= NaNO3
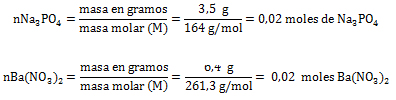
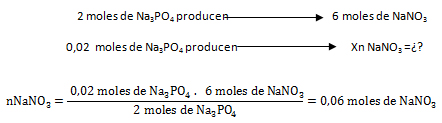
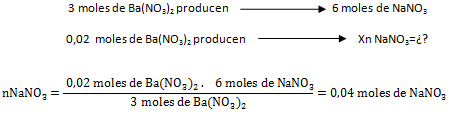
El reactivo limitante es aquél que origina la menor cantidad de moles de producto, o sea que el Ba(NO3)2 es el reactivo limitante y el Na3PO4 el reactivo en exceso.


Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 76-99.