 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
A continuación se estudiarán los problemas referentes al cálculo del reactivo limitante, rendimiento teórico, rendimiento práctico y porcentaje de rendimiento de la reacción.
Ejercicios:
1. En la siguiente reacción química se hacen reaccionar 15,32 gramos de Mg con 31,45 gramos de HCl.
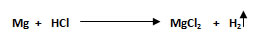
- Si el rendimiento real del H2 es de 8,25 litros, determinar en CN:
a.- ¿Cuál es el reactivo limitante?
b.- El rendimiento teórico de la reacción.
c.- El % de rendimiento de la reacción.
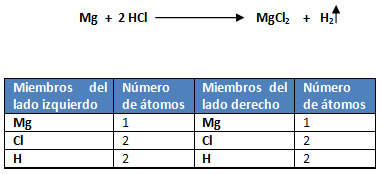
mMg= 15, 32 gramos; m HCl= 31,45 gramos; Rendimiento práctico= 8,25 litros de H2 ; reactivo limitante= ¿?; Rendimiento teórico= ¿?; % de rendimiento de la reacción= ¿?.
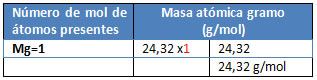
M= Mg
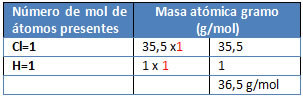
M= HCl

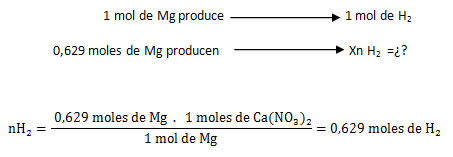
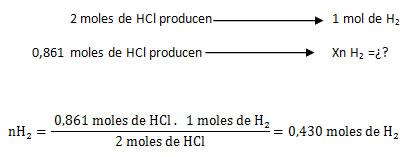
El reactivo limitante es aquél que origina la menor cantidad de moles de producto, o sea que el HCl es el reactivo limitante y el Mg el reactivo en exceso.


Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 76-99.