 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Ejercicio 2. Se tienen 25 gramos de vapor de agua. Por enfriamiento pasan a la fase líquida. ¿Qué cantidad de calor ceden los 25 gramos de vapor, al cambiar de fase? Vapor de agua, ΔHv= 9, 71 Kcal/mol.
M= H2O
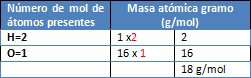
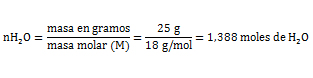
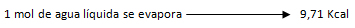
Dado a que la condensación o licuefacción es el proceso inverso de la vaporización de una sustancia, se escribe el mismo valor pero con signo negativo, lo cual indica que durante el proceso se desprende la misma cantidad de calor que se consume durante la vaporización.

Ejercicio 3. Calcule los valores de ΔHs para cada sustancia señalada en la siguiente tabla:
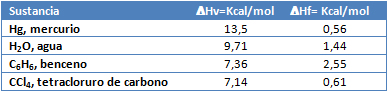
ΔHs = ΔHf + ΔHv
a) Mercurio, Hg:
ΔHs = 0,56 Kcal/mol + 13,5 Kcal/mol = 14,06 Kcal/mol.
b) Agua, H2O:
ΔHs = 1,44 Kcal/mol + 9,71 Kcal/mol = 11,15 Kcal/mol.
c) Benceno, C6H6:
ΔHs = 2,55 Kcal/mol + 7,36 Kcal/mol = 9,91 Kcal/mol.
d) Tetraclocuro de carbono, CCl4:
ΔHs = 0,61 Kcal/mol + 7,14 Kcal/mol = 7,75 Kcal/mol.
Referencias bibliográficas:
Cuerpo de redacción (1997). Mentor interactivo. Enciclopedia temática estudiantil. Editorial Océano. Barcelona, España. Pág: 200-203.