 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Tipos de fase
Las fases que pueden estar presentes en un sistema son: fase sólida, fase líquida o fase gaseosa.
La fase sólida, representada con la letra “s” en el subíndice de la sustancia a estudiar (X(s)), es aquella fase en donde los átomos y las moléculas se encuentran unidos fuertemente por lo que se trata de una estructura muy ordenada. Considerando al agua como sustancia de estudio, el hielo representa la fase sólida del sistema agua, mediante la fórmula: H2O(s).
La fase líquida, representada con la letra “l” en el subíndice de la sustancia a estudiar (X(l)), es aquella fase en donde los átomos y las moléculas no se encuentran unidos tan fuertemente como en el caso de los sólidos, por lo que se trata de una sustancia capaz de mantener cierto orden y libertad de movimiento. Continuando con el sistema agua, el agua líquida, la que se toma diariamente, es un ejemplo de fase líquida representado por la fórmula: H2O(l).
La fase gaseosa, representada con la letra “g” en el subíndice de la sustancia a estudiar (X(g)), es aquella fase en donde los átomos y las moléculas no se encuentran unidos fuertemente, es decir, se tratan de uniones muy débiles por lo que las partículas se mueven libremente y en forma aleatoria. Continuando con el sistema agua, el agua gaseosa, la que se obtiene del vapor de la misma, es un ejemplo de fase gaseosa representado por la fórmula: H2O(g).
Cambios de fase
Para que se dé el cambio de fase denominado fusión, se debe suministrar energía calórica a la sustancia a estudiar. Si el hielo es colocado a temperatura ambiente o se le suministra energía calórica, el mismo se fusiona a agua líquida ya que absorbe el calor para vencer la fuerza de atracción que lo mantiene unido fuertemente. Se denomina calor de fusión a la cantidad de calor absorbida por el hielo para pasar a su fase líquida.
Si la cantidad de sustancia objeto de estudio es de 1 mol, se le llama calor molar de fusión, el cual es una característica propia de cada sustancia. El calor molar de fusión se representa por ΔHf, que para el agua tiene un valor de 1440 calorías/mol.
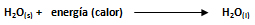
Siguiendo la terminología utilizada, el calor molar de congelación o solidificación, el cual sería el proceso inverso, representa la energía desprendida por las partículas para pasar a su fase sólida, lo que es igual al número de calorías desprendidas por mol de sustancia congelada o solidificada.
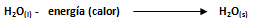
El calor molar de vaporización representa el cambio de fase gaseoso llamado vaporización, cuando un líquido se calienta hasta su punto de ebullición o lo que es igual, la cantidad de calor absorbido por mol de sustancia, representado por ΔHv, que para el agua tiene un valor de 9700 calorías/mol.
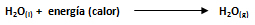
En la condensación o licuefacción, el proceso inverso, se desprende la misma cantidad de calor que en la vaporización de una sustancia.
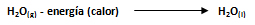
Constantes en los cambios de fase
Los cambios de fase propios de cada sustancia se realizan bajo presión constante, por lo que la variación de energía que los acompaña se representa por la magnitud termodinámica llamada entalpía, que se simboliza con la letra H; sin embargo es más común encontrar el término llamado ΔH (se lee delta H), que señala la variación energética correspondiente. Si ΔH está precedido de un signo positivo el proceso es endotérmico, es decir, se absorbe energía. Si ΔH está precedido de un signo negativo, el proceso es exotérmico, se desprende energía en forma de calor.
La sublimación se refiere al paso de la fase sólida a la fase gaseosa sin pasar por la fase líquida. El calor molar de sublimación indica a la variación de la entalpía que acompaña a dicho cambio de un mol de sustancia a presión constante. Se simboliza por ΔHs.
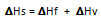
Estudiemos los cambios de fase (reversibles) utilizando la simbología de ΔHf y ΔHv.
Cambio de fase:

La información indica que cuando un mol de hielo se funde a presión constante absorbe 1,44 Kcal.
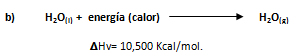
La información indica que cuando un mol de agua se evapora a presión constante absorbe 10,500 Kcal.
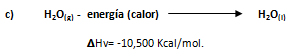
La información indica que cuando un mol de vapor de agua se condensa a presión constante desprende 10,500 Kcal.
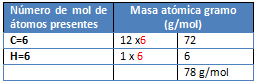
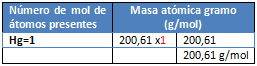
Ejercicio 1. Calcule la cantidad de calor que debe suministrarse a: a) 10 gramos de hielo, b) 100 gramos de benceno y c) 100 gramos de mercurio para que se fundan. Hielo, ΔHf= 1,44 Kcal/mol. Benceno, ΔHf= 2,55 Kcal/mol. Mercurio, ΔHf= 0,56 Kcal/mol.
M= H2O
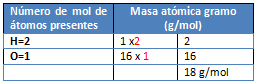
M= C6H6
M= Hg

Referencias bibliográficas:
Cuerpo de redacción (1997). Mentor interactivo. Enciclopedia temática estudiantil. Editorial Océano. Barcelona, España. Pág: 200-203.