 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Las disoluciones o soluciones químicas son sistemas o medios homogéneos, es decir, mezclas de una fase, en donde un compuesto interacciona con otro compuesto, disolviéndose completamente.

Las disoluciones pueden estar formadas por muchos compuestos, sin embargo para su estudio en química, nos limitamos a dos compuestos:
Un soluto: se encuentre en menor cantidad y es el que se disuelve.
Un solvente: se halla en mayor cantidad, y es el lugar en donde se da la disolución. El solvente también es conocido como disolvente, medio de dispersión, entre otros términos.
Ejemplo: el agua salada es una disolución o solución química. En este caso, el agua es el solvente y la sal, el soluto.
Generalmente en química inorgánica, el solvente que más se utiliza es el agua, también denominada solvente universal por su extraordinaria capacidad de disolver la mayoría de las sustancias. El agua es el medio en donde se regulan todos los procesos bioquímicos de los seres vivos, formando parte fundamental de la hidrósfera al controlar diferentes factores ambientales e industriales, entre otros.
Molecularmente, en una disolución el agua es una especie activa ya que en ella los dipolos reaccionan con las moléculas del soluto para formar especies polares o iónicas que luego se transforman en especies solvatadas, esto se refiere al efecto del agua sobre los iones para apantallar sus cargas eléctricas, ya que así es más fácil que éstos se acerquen y reaccionen entre sí, y al mismo tiempo se mantengan separados dentro de la disolución. En la figura 1, se ilustra la disolución de sal común o NaCl (soluto) en iones en el agua (solvente).
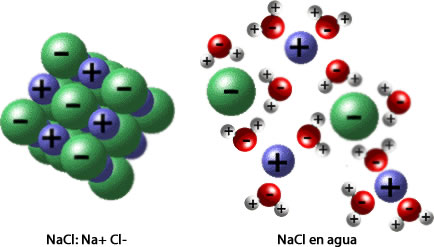
Figura 1. Presentación a nivel molecular de la disolución de sal común en agua.
Es importante comprender cómo ocurre ésta dispersión o proceso de disolución a nivel molecular o iónico de un soluto en un solvente, ya que de ese proceso se tratan las disoluciones, constituyendo un sistema homogéneo u ópticamente vacío, que a simple viste puede verse como transparente una vez que todas las moléculas de soluto estén disueltas en el disolvente.
CLASIFICACIÓN DE LAS DISOLUCIONES QUÍMICAS
Las disoluciones pueden clasificarse en función al estado de agregación en el que se encuentran ambos compuestos o en función a su concentración química.
En una disolución tanto el soluto como el solvente pueden estar presentes en diferentes estados de agregación, sólido, líquido o gaseoso, por lo que en caso de que ambos estén en el mismo estado, se dice que el solvente es el componente que está en mayor cantidad y el otro componente sería el soluto. En la tabla 1, se listan diferentes disoluciones en función al estado de agregación del soluto y el solvente.

Según el tamaño de las partículas de soluto se tienen dos tipos de mezclas homogéneas, soluciones coloidales y soluciones verdaderas. Ambos tipos de mezclas pueden separarse por destilación, cristalización y cromatografía.
Las partículas de las soluciones coloidales poseen un diámetro entre 10-5 cm a 10-7 cm, por lo que muchas veces sucede que al observarlas podemos confundirlas con las soluciones verdaderas. Ejemplo de ellas son la gelatina, la leche de magnesia, el vidrio de rubí, nieblas, pinturas, entre otros.
Las partículas de las soluciones verdaderas poseen un diámetro entre 10-7 cm a 10-8 cm, las cuales comprenden las partículas a nivel de átomos y moléculas. En la figura 2, se observa la comparación entre el tamaño de las partículas de ambos tipos de mezcla junto con las suspensiones, un tipo de mezcla heterogénea.

Figura 2. Tamaño de las partículas en diferentes tipos de mezclas.
(Realizado tomando como ejemplo una imagen de Suárez, 1994).
En 1869, John Tyndall, descubrió un fenómeno físico propio de los coloides, llamado efecto Tyndall en su honor. Este fenómeno permite explicar una característica de estas mezclas, que es la dispersión de luz. Cuando se hace atravesar un rayo de luz en una mezcla homogénea y sus partículas son observadas a simple vista, estamos en presencia de un coloide, mientras que si al pasar la luz no se observa ese efecto estamos frente a una solución verdadera (Fig. 3). A través de éste método sencillo se puede determinar la naturaleza de las disoluciones a simple vista.

Figura 3. Efecto Tyndall. La muestra en amarillo representa una solución verdadera, sin dispersión de luz, mientras que la solución de color rojo es un coloide, observándose la dispersión de la luz.

Gracias al efecto Tyndall se pueden ver las partículas de niebla al ser cruzadas por rayos de luz.
Según su concentración, las disoluciones pueden expresarse cualitativamente o cuantitativamente. El término concentración hace referencia a la cantidad de soluto disuelto en un solvente, por lo que es una característica que se utiliza para determinar la composición química de una solución.
La concentración puede ser expresada cualitativamente, a través de los términos diluido y concentrado en función a la cantidad de soluto presente en la solución.

Figura 4
Las soluciones diluidas son aquellas en donde el soluto está en una proporción muy pequeña con respecto al volumen total de la disolución.
Las soluciones concentradas son aquellas en donde la proporción del soluto es grande con respecto al volumen final de la disolución. Dentro de las disoluciones concentradas pueden existir soluciones insaturadas, aquellas en donde se disuelve el soluto sin llegar a la saturación; soluciones saturadas, aquellas donde se disuelve la mayor cantidad de soluto capaz de mantenerse disuelto, a una temperatura estable, y tanto el soluto como el solvente se encuentran en equilibrio; y soluciones sobresaturadas, aquellas donde la cantidad de soluto es mayor que en la solución saturada, por lo que el equilibrio en los componentes es inestable, y dependiendo de las condiciones físicas puede darse la precipitación del soluto en la mezcla.

La concentración puede expresarse cuantitativamente, estableciendo diferentes relaciones porcentuales entre las cantidades de sustancias, a través de unidades químicas y físicas, conocidas como: la masa (m), el volumen (v) y la cantidad de sustancia (n). Dentro de los cálculos que se realizan con mayor frecuencia, se tiene:
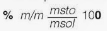
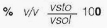
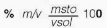
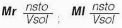
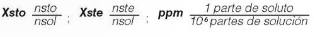
Donde msto son los gramos de soluto, mste los gramos del solvente, msol los gramos de la solución, vsto el volumen de soluto, vsol el volumen de solución, Mr la molaridad, Ml la molalidad, nsto número de moles de soluto, Xsto fracción molar de soluto, nsol número de moles de solución, Xste fracción molar de solvente, nste número de moles de solvente, y ppm partes por millón.

El manejo cuantitativo de las disoluciones tiene mucha importancia en diferentes aspectos de la vida cotidiana, como en la elaboración de medicamentos, de exámenes médicos, a nivel industrial para estudios del petróleo, en la industria de perfumes, de bebidas, entre otros,
