 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS



¿Cuántas veces hemos encontrado algún objeto oxidado? Te invitamos a aprender más sobre este fenómeno. Adentrémonos en el mundo de los átomos para ver qué sucede con ellos en esta reacción química.

Para comprender cómo se genera este fenómeno, antes debemos saber qué es la oxidación. Es una reacción química donde un elemento cede electrones. La reacción química opuesta a la oxidación es la reducción, es decir cuando una especie química acepta electrones. Estas dos reacciones siempre se dan juntas: cuando una sustancia se oxida, siempre hay otra que se reduce.
El oxígeno, un gas incoloro, inodoro e insípido, tiene la capacidad de oxidar a otras sustancias aceptando sus electrones y así formando óxidos. Se encuentra en la naturaleza, específicamente en la atmósfera y en la corteza terrestre mezclado con otros gases, siendo soluble en agua.
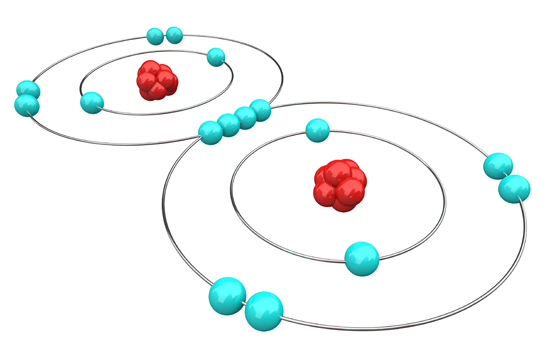
Diagrama de átomos de oxígeno.
Tipos de oxidación
Las oxidaciones se pueden clasificar como lentas o rápidas, en función al tiempo que tome darse la reacción y a los cambios de temperatura con desprendimiento de luz y calor (energía).
Oxidaciones lentas: es un proceso en el cual el oxígeno oxida a los materiales de manera gradual, con diferentes manifestaciones de este proceso a lo largo del tiempo, por ejemplo la formación de herrumbre en el hierro.
La corrosión de materiales es un tipo de oxidación lenta, en donde se da un deterioro gradual del metal a lo largo del tiempo. Por ejemplo, la oxidación del hierro, en donde se forman óxidos ferrosos o de hierro gracias al oxígeno atmosférico y a la humedad.

El herrumbre es el óxido del hierro.
Oxidaciones rápidas: en este proceso tenemos emisión de luz y calor. Algunos ejemplos son: cuando se enciende un papel o una cerilla; o cuando una fruta, sin su cáscara, queda expuesta al aire y se torna de un color marrón claro.
La combustión es una reacción química con oxidación rápida y desprendimiento de calor y luz, es decir, los materiales se queman y desprenden energía; si se queman con facilidad se los denomina combustibles, caso contrario se los denomina incombustible.
Redox
Las reacciones de reducción y oxidación, también son conocidas con el nombre redox. Son reacciones químicas que transcurren con transferencia de electrones desde el sistema reductor al sistema oxidante. Siempre son la suma de dos semirreacciones, cada una de las cuales representa la oxidación del reductor y la reducción del oxidante respectivamente.
Terminología química
Para comprender mejor el fenómeno de la oxidación, a continuación se detalla cómo suceden algunas reacciones químicas.
Ejemplos:
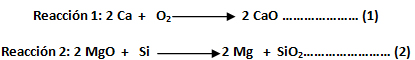
En la reacción 1, el calcio (Ca) gana oxígeno transformándose en óxido de calcio (CaO), lo que constituye un ejemplo de oxidación; mientras que en la reacción 2, el óxido de magnesio (MgO), pierde oxígeno convirtiéndose en magnesio elemental (Mg), siendo un ejemplo de reducción. Sin embargo, ambos procesos, más que un aumento o disminución del contenido de oxígeno involucran un intercambio de electrones entre los átomos. En función a ambas reacciones se estudian los conceptos químicos de oxidación y reducción.
Oxidación
Siguiendo el ejemplo de la reacción 1, el intercambio de electrones puede estudiarse con dos semirreacciones o ecuaciones electrónicas, con índices en forma de exponente, que indican su carga electrónica:
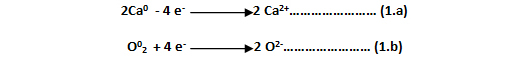
En donde cada átomo de calcio ha perdido dos electrones (- 4 e- ), transformándose en los iones calcio (Ca2+ ), mientras que el oxígeno molecular, o lo que es igual a los dos átomos de oxígeno que constituyen dicha molécula, ha aceptado o ganado dos electrones cada uno (+ 4 e- ), siendo ahora iones de oxígeno (O-2 ). Por otra parte, el índice 0, indica que no tiene ni exceso ni falta de electrones, lo que significa que su carga es neutra, caso que sucede para todas las moléculas.
Siempre que se analicen reacciones de oxidación o de pérdida de electrones, sucede recíprocamente una reducción o ganancia de electrones por parte del oxígeno u otro aceptor de electrones. Obsérvese otro ejemplo en donde el aceptor de electrones no es el oxígeno:

En este caso, sus dos semirreacciones o ecuaciones electrónicas son:
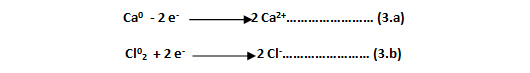
Aquí, el átomo de calcio ha perdido dos electrones (- 2 e- ), transformándose en el ión calcio (Ca2+), mientras que el cloro molecular o lo que es igual a los dos átomos de cloro que constituyen dicha molécula, ha aceptado o ganado un electrón cada uno (+2 e-), convirtiéndose en un ión cloro (Cl-), siendo ahora el cloro el aceptor de electrones.
Según lo anterior, la oxidación es un cambio químico en el que un átomo o conjunto de átomos experimenta una pérdida de electrones.
Reducción
Como ya se mencionó, la reacción opuesta a la oxidación es la reacción de reducción. Siguiendo el ejemplo anterior, el óxido de magnesio (MgO) pierde oxígeno, por lo que se reduce, mientras que el silicio (Si), ha ganado oxígeno, oxidándose. Sin embargo, al analizar el intercambio de electrones se tiene una mayor comprensión de lo que le ha sucedido a cada átomo, a través de las dos semirreacciones o ecuaciones electrónicas:
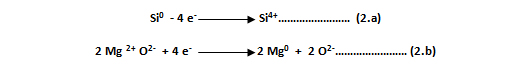
El átomo de silicio neutro ha perdido cuatro electrones (- 4 e- ), transformándose en el catión silicio (Si4+), mientras que los dos átomos de magnesio, han aceptado o ganado dos electrones cada uno (+ 4 e- ), pasando de su forma iónica a neutra (Mg0). El oxígeno que inicialmente estaba unido al magnesio no sufre ningún cambio electrónico, uniéndose luego al silicio.
Veamos un ejemplo de una reacción de reducción o de ganancia de electrones, en donde no participa el oxígeno:

Siendo sus dos semirreacciones o ecuaciones electrónicas:
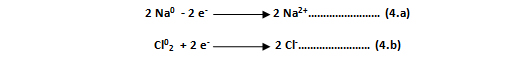
Cada átomo de sodio (Na) ha perdido un electrón (- 2 e- ), transformándose en el catión sodio (Na2+), mientras que el cloro molecular o lo que es igual a los dos átomos de cloro que constituyen dicha molécula, ha aceptado o ganado un electrón cada uno (+ 2 e-), convirtiéndose en el anión cloro (Cl-).
Según lo anterior, la reducción es un cambio químico en el que un átomo o conjunto de átomos experimenta una ganancia de electrones.
Reacciones de oxidación y reducción
Las reacciones redox involucran una pérdida y una ganancia de electrones. Siempre el número de electrones perdidos o donados durante el proceso de oxidación será igual al número de electrones ganados o aceptados durante el proceso de reducción.
Para facilitar el estudio de la reacciones redox se habla de pérdida y de ganancia de electrones, sin embargo se debe aclarar que dicha pérdida o ganancia de electrones se da propiamente en la formación de enlaces electrovalentes.
Número de oxidación
Cada átomo de un compuesto viene caracterizado por su estado de oxidación; es decir, por el número de electrones ganados o perdidos (total o parcialmente) por ese átomo, al pasar a formar parte del compuesto en cuestión.
El estado de oxidación de un átomo o molécula es llamado valencia o número de oxidación, si corresponde a electrones ganados, será un número negativo, y si corresponde a electrones perdidos, será positivo.
Dado a que no siempre es fácil descubrir cuál es el compuesto que se oxida y cuál se reduce, se han establecido de manera general determinadas reglas para asignar el número de oxidación de un átomo o compuesto dado, teniendo siempre en cuenta el compuesto en el que se halle. Las reglas son las siguientes:
a) Un elemento aislado siempre tiene un número de oxidación de cero, esté o no en forma monoatómica o poliatómica. Ejemplos: P4, Hg, Cl2.
b) La suma algebraica de números de oxidación positivos y negativos de los átomos de un compuesto dado siempre es cero. Esta regla facilita detectar el número de oxidación de los átomos involucrados en dicha molécula. Ejemplo:

c) El número de oxidación del oxígeno generalmente es dos negativo (-2), pero en los peróxidos trabaja con el número de oxidación uno negativo (-1).
d) El hidrógeno combinado con metal tiene número de oxidación uno positivo (+1), mientras que en hidruros de metales alcalinos y alcalinotérreos tiene número de oxidación uno negativo (-1).
e) El número de oxidación de un ión es igual a su carga. Ejemplos: metales alcalinos (+1), alcalinotérreos (+2).
f) El número de oxidación de no metales es negativo, a excepción de que se encuentre unido a otro no metal. En este caso el signo de cada número de oxidación dependerá de la electronegatividad de los átomos.
g) En todos los haluros, el número de oxidación del halógeno es uno negativo (-1).
h) En los sulfuros, el número de oxidación del azufre es dos negativo (-2).
En función a estas reglas se puede generalizar que los conceptos químicos de oxidación y reducción constituyen el proceso en donde un átomo o grupos de átomos pierden o ganan electrones, aumentando o disminuyendo su número de oxidación.
Para facilitar la determinación del número de oxidación se suelen utilizar escalas que comprenden números enteros, generalmente desde -7 hasta +7, en una recta numérica real. La dirección de la flecha indica si el elemento se ha reducido u oxidado, así como indica el número de electrones ganados o perdidos durante la reacción.
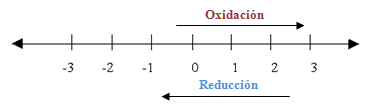
Escala de los números de oxidación.

Los agentes oxidantes más importantes son el oxígeno, el ozono, el peróxido de hidrógeno, halógenos, sales, dióxidos, algunos ácidos, entre otros.


Los agentes reductores más importantes son el carbono, el hidrógeno, el azufre, el hierro, las amalgamas de algunos metales, entre otros.