 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS

Los elementos químicos pueden clasificarse de diversas formas de acuerdo a sus propiedades. De hecho, si lo hiciéramos en tres grupos distintos obtendríamos la siguiente clasificación: metales, no metales y metaloides. Por su parte, los gases nobles son elementos químicos que no reaccionan frente a otros, por lo que también se denominan inertes y forman parte del grupo de los no metales.

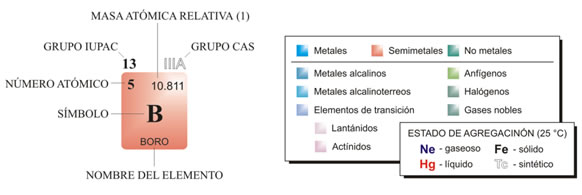
CLASIFICACIÓN
Tanto los no metales como los metales y metaloides están distribuidos en la tabla periódica. Algunas tablas indican con otro color a los gases nobles, para diferenciar sus características con respecto al resto de los elementos, como la siguiente:

Algunas tablas periódicas brindan más información que otras y utilizan diversos colores para realizar divisiones más específicas, como podemos observar en la TABLA 2. En ella se utilizan tonos de verde para los no metales, siendo los gases nobles aquellos que poseen un verde más oscuro. Por otra parte los metales están identificados con tonos de azul. Con rojo se hallan los metaloides o semimetales.

Cuando vayas a utilizar una tabla periódica, lo primero que debes hacer es familiarizarte con las indicaciones que aparecen en las referencias. Dichas indicaciones te permitirán leer la información de cada elemento. Es necesario que elijas una tabla que contenga la información que vayas a necesitar, ya que a veces el uso de tablas muy completas, con puntos de fusión, punto de ebullición, energía de ionización, etc., puede causar confusión.
En la tabla anterior, las referencias son:
Antes de estudiar qué son los metales, no metales y metaloides en profundidad, es necesario comprender algunas características de la tabla periódica. La misma agrupa a los elementos según propiedades químicas y físicas semejantes. Está organizada en forma secuencial, de acuerdo a su número atómico, conteniendo filas (períodos) y columnas (grupos).
Según sea el nivel de estudio, los elementos químicos pueden clasificarse de diversas formas de acuerdo a la profundidad con la que se desee analizarlos:

Fragmentos de uranio: en la actualidad se utiliza principalmente como combustible para los reactores nucleares.
LOS METALES
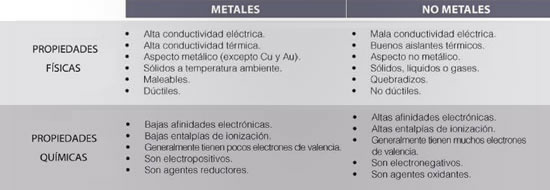
Generalmente, los metales tienen entre uno y tres electrones en la última órbita y, por lo tanto, tienden a ceder electrones para formar enlaces químicos. Por ello, son buenos conductores del calor y la electricidad. Sus propiedades más destacadas son la maleabilidad, la ductilidad y el brillo. El 75% de los elementos químicos son metales.
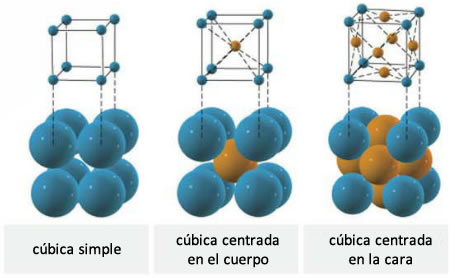
Estructura de los metales
Los elementos metálicos forman empaquetamientos compactos, cúbicos, hexagonales, etc. Las redes cristalinas más comunes en los metales son:
Abundancia de los metales en la naturaleza
La mayoría de los metales tiene origen mineral. Los minerales son sustancias que se encuentran en la naturaleza y suelen formar depósitos que tienen gran valor económico. Cuando es posible extraer un metal de un mineral, a este último se lo denomina mena.

Fotografía de una galena. Este mineral es mena del plomo.
Los metales más abundantes que pueden hallarse en menas son: hierro, calcio, aluminio, magnesio, potasio, sodio, titanio y manganeso.
Metalurgia
La metalurgia es la ciencia y tecnología de la separación de los metales a partir de sus menas y de la preparación de aleaciones.
Para extraer un metal de una mena, primero se separan los materiales de desecho, que suelen ser arcillas y ganga (minerales de silicatos). El método de separación más utilizado es la flotación, que se realiza luego de moler la mena y agregarle agua, con aceite y detergente. Al realizar este procedimiento se produce espuma, para que la ganga quede en el fondo y las partículas deseadas asciendan.

Producción de acero en una metalúrgica.
En caso de que los metales que se quieran extraer sean ferromagnéticos, como la magnetita o el cobalto, se puede utilizar el método de imantación, ya que dichos metales pueden ser atraídos por los imanes.
La utilización de mercurio para la obtención de otros metales, se realiza en el caso de las amalgamas, ya que las mismas se componen de mercurio y otro metal o metales. Esto ocurre porque el mercurio disuelve a la plata y al oro, formando una amalgama líquida que se puede separar fácilmente.
Hierro
El hierro existe en minerales diferentes, la pirita de hierro, la siderita, la magnetita y la hematita. Se extrae de ellos mediante un proceso metalúrgico que implica la utilización de calor en un "alto horno". De esta forma se obtiene hierro de fundición, el cual contiene gran cantidad de impurezas.

La hematita constituye una importante mena de hierro, ya que en estado puro contiene un 70% de este metal.
Acero
El acero no se produce en forma artificial, sino que es una aleación que tiene principalmente hierro y carbono, lo que mejora las propiedades físicas y químicas del primero. El proceso de conversión de hierro en acero consiste en oxidar el metal para separar las impurezas que se desean eliminar de su composición. Para ello, se utiliza "el proceso básico de oxígeno", en el cual se adiciona oxígeno gaseoso a presión sobre el hierro fundido proveniente del alto horno. De este modo se favorece la reacción con el oxígeno del fósforo, el manganeso, el silicio y el exceso de carbono, dando origen a los óxidos que junto a ciertos fundentes componen la escoria, una sustancia vítrea que flota en el crisol de los hornos y que procede de las impurezas.
NO METALES:
En su última órbita, estos elementos contienen entre cinco y siete electrones, lo que permite la recepción de electrones para completarla con los ocho necesarios para lograr la estabilidad, según la regla del octeto. Son malos conductores del calor y la electricidad, no poseen brillo y son frágiles en estado sólido.
Estructura de los no metales
Al clasificar a los elementos químicos en metales, no metales y metaloides, los gases nobles están incluidos en los no metales.
Subgrupos de los no metales:

Fullereno esférico, conocido como buckyball.
Ambas estructuras implican que las propiedades de dichas variedades difieran en gran medida.

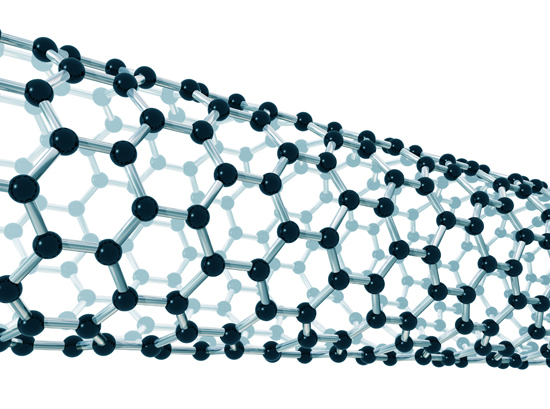
Nanotubo de carbono. Los nanotubos son ampliamente estudiados en la actualidad, ya que permiten diversas aplicaciones, sea en la industria, en la medicina, en el almacenamiento de energía, y en electrónica.
Extracción de los no metales
Los gases nobles son poco reactivos, encontrándose principalmente en el aire. En tanto, los halógenos son muy reactivos, por lo que se encuentran combinados en la naturaleza. Los gases que componen el aire pueden ser extraídos mediante destilación fraccionada del aire líquido. Los halógenos se obtienen generalmente por oxidación electrolítica. El resto de los no metales pueden obtenerse por diversos métodos, entre ellos el de reducción.
DIFERENCIAS ENTRE METALES Y NO METALES
LOS METALOIDES O SEMIMETALES
Por lo general poseen cuatro electrones en su último orbital, por lo tanto, sus propiedades son intermedias entre los no metales y los metales. Como conducen la electricidad en un solo sentido, son utilizados para fabricar semiconductores.
Aplicaciones de algunos metaloides:

Imagen de una antimonita, mena principal del antimonio, metal relativamente raro y elemento tóxico utilizado para endurecer aleaciones de metal.
CONDUCTORES, SEMICONDUCTORES Y AISLANTES
Conductores: los metales tienen alta conductividad eléctrica, ya que los átomos se encuentran muy cercanos unos de otros lo que, a su vez, permite el paso de los electrones entre orbitales. Dicha interacción origina "bandas de conducción". En un metal, la banda de conducción está casi llena, por lo que permite el paso de los electrones desde su banda de valencia (en donde se hallan los electrones deslocalizados) hacia la de otro.
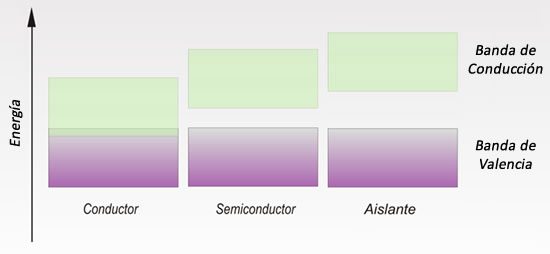
Semiconductores: son elementos que se comportan como conductores o aislantes, según los factores a los que estén expuestos, por ejemplo campos eléctricos y magnéticos. Los metaloides tienen esta característica, al igual que algunos metales pobres, como el aluminio y el galio, entre otros. El semiconductor más utilizado es el silicio, seguido por el germanio, ambos metaloides.
Aislantes: son materiales que resisten el paso de la corriente debido a que la distancia entre las bandas de valencia y las de conducción son grandes, necesitando mucha cantidad de energía para que un electrón se traslade de una banda a otra.