 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS








Las primeras leyes de los gases comenzaron a desarrollarse a fines del siglo XVII, pero antes de entrar de lleno en ellas, haremos un repaso que nos ayudará a comprender mejor el tema.
Observando a nuestro alrededor podemos apreciar una gran variedad de objetos de distintos tamaños, formas y colores; también podemos ver una diversidad de seres vivos como animales, hongos y plantas. Unos y otros tienen entre sí un denominador común: ocupan un lugar en el espacio y se ven afectados por las fuerzas gravitatorias, lo que define a todos como materia.
La materia está formada por millones de unidades básicas conocidas como moléculas, las cuales están unidas entre sí. El grado de unión o separación entre ellas determinará sus propiedades físicas y químicas; es por ello que dichas propiedades se usan para la identificación y diferenciación de la materia. Desde muy chicos hemos aprendido a distinguir los tres estados en que la materia se presenta en la Tierra: sólido, líquido y gaseoso, basados en nuestras percepciones sensoriales. Sin embargo, la determinación del estado de la materia, así como de sus propiedades físicas y químicas, requiere del conocimiento de procesos que se dan en función a la temperatura y la presión.

Para comprender, por ejemplo, qué es el estado gaseoso, es necesario compararlo con los demás estados, en función a las fuerzas de cohesión. En la fuerza de cohesión la atracción mutua se da entre materiales de una misma naturaleza, como las moléculas que forman una barra de metal, un determinado volumen de agua o del oxígeno atmosférico.

COMPORTAMIENTO DE LOS GASES
Las partículas que forman los gases tienen libertad de movimiento debido a la existencia de grandes espacios intermoleculares, y tienden a ocupar el máximo volumen. El comportamiento de los gases está influenciado por la temperatura, la presión, el volumen y la cantidad de materia.
Las moléculas que componen los gases chocan elásticamente entre sí y con las paredes del recipiente en donde están contenidas, lo que provoca la presión gaseosa, es decir, la fuerza dirigida desde el seno del gas hacia las paredes del recipiente. Si el recipiente aumenta de volumen, el gas ocupa inmediatamente el nuevo espacio y disminuye su presión. La propiedad que les permite a los gases posicionarse hasta ocupar todo el volumen de un recipiente, se denomina expansibilidad.

Al aumentar la presión exterior, las partículas que forman los gases disminuyen sus distancias relativas y el gas se comprime, es decir, pasa al estado líquido. Esta propiedad de los gases se denomina compresibilidad, y puede observarse claramente en la naturaleza, en el rocío y la humedad durante el ciclo del agua (condensación). La compresibilidad es aprovechada para transportar y almacenar con mayor facilidad los gases en forma líquida, utilizando, por ejemplo, los recipientes conocidos como cilindros de gas.
En física, la presión se define como la relación que existe entre una fuerza y la superficie sobre la que se aplica. En el Sistema Internacional, la unidad de presión se denomina pascal (1 Pa= 1 N/m2). La presión también se expresa en atmósferas, siendo 1 atm equivalente a la presión media a nivel del mar a 0°C y 45° de latitud. Otra unidad muy utilizada son los milímetros de mercurio, la altura de una columna de mercurio que equivaldría a esa presión, con la equivalencia 1 atm= 760 mm de Hg.
La temperatura ejerce gran influencia sobre el estado de las moléculas de un gas, aumentando o disminuyendo la velocidad de las mismas.
Al aportar calor al recipiente que contiene el gas, se produce un aumento de la velocidad media de la moléculas que eleva su presión, esto es, aumenta la agitación molecular y los choques contra las paredes del recipiente son más violentos. Para el estudio de los gases, la temperatura es medida en Kelvin.
El comportamiento de los gases en función a la presión y la temperatura constituye la llamada teoría cinética de los gases. La teoría cinética superó la visión estática de la materia y afirmó que la misma está sometida a un estado de agitación que depende de la temperatura (agitación térmica) y a la vez que existen restricciones a ese movimiento que dependen de fuerzas intermoleculares (cohesión), despreciables en el caso de los gases, debido a la atracción que cada núcleo ejerce sobre las cortezas de los átomos vecinos (Fuerza de Van der Waals).

Los gases ocupan todo el volumen disponible del recipiente que los contiene. Para medir el volumen, se utilizan las unidades de litro (L), mililitros (mL), etc.
Las condiciones en las que se halla un gas quedan definidas por la presión que ejerce, por el volumen que ocupa y la temperatura a la que se encuentra (P, V, T). Estas variables se denominan funciones de estado porque tiene un valor preciso para cada estado del gas.
Otro parámetro que debe tomarse en cuenta al estudiar el comportamiento de los gases es la cantidad de sustancia de un gas, la cual se relaciona con el número total de moléculas que la componen, utilizando como unidad de medida el mol.
1 mol de moléculas = 6,02. 1023 - 1 mol de átomos = 6,02. 1023
LEYES EXPERIMENTALES DE LOS GASES
Ley de Boyle-Mariotte
En 1662, el químico británico Robert Boyle descubrió experimentalmente que la compresibilidad del aire es inversamente proporcional a la presión que ejerce sobre él. Concluyó que el aire debía estar formado por pequeñas partículas muy separadas, de manera que la compresión consistía en aproximar a éstas entre sí.
Más tarde, en 1676, el físico francés Edmé Mariotte, descubrió que el aire se expandía al aumentar la temperatura y que se comprimía al disminuirla. La relación inversa entre el volumen y la presión de un gas estudiada por Boyle, solo era válida si se mantenía constante la temperatura. Estos resultados se generalizaron en la ley de Boyle-Mariotte, la cual enuncia que, a temperatura constante, los volúmenes ocupados por una masa de gas seco son inversamente proporcionales a la presión que soportan, es decir, si la presión aumenta, el volumen disminuye o si la presión disminuye, el volumen aumenta. La expresión matemática de este enunciado es:
P . V = K (constante para cada temperatura) = P1 . V1 = P2 . V2
Ejemplo: a temperatura constante se tienen 2 L de un gas que están a 600 mm Hg de presión. ¿Cuál será su volumen si aumentamos la presión hasta 900 mm Hg? Sustituyendo en la fórmula se tiene:
600 mmHg . 2L = 900 mm Hg . V2
Despejando a V2

Ley de Charles y Gay- Lussac
La dilatación de los gases con la temperatura fue estudiada en primer lugar en 1787, por el físico francés Jacques-Alexandre Charles, quien demostró que los gases se expandían de igual modo con un mismo aumento de la temperatura, llegando a determinar que, a presión contante, el volumen de un gas aumentaba o disminuía en 1/273 partes del volumen inicial, por cada grado centígrado que aumentaba o disminuía la temperatura.
Poco después el físico francés Joseph-Louis Gay-Lussac, redescubrió el experimento de Charles y lo publicó en el año 1802. De manera directa esta ley enuncia que si aumenta la temperatura aplicada al gas, el volumen del gas aumenta, y si disminuye la temperatura aplicada al gas, el volumen del gas disminuye. La expresión matemática de esta Ley es:

Ejemplo: a presión constante un gas cuya temperatura llega a 298 K tiene un volumen de 2 L. Al disminuir la temperatura a 283 K ¿Cuál será su volumen final?
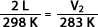
Despejando a V2
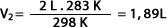
Gay-Lussac presentó luego una segunda ley, referida a la variación de la presión con la temperatura a volumen constante enunciando que, a volumen constante, el aumento unitario de la presión es proporcional al aumento de la temperatura. Esto indica que si se aumenta la temperatura, aumentará la presión y si se disminuye la temperatura, disminuirá la presión. La expresión matemática de este enunciado es:

Ejemplo: a volumen constante se tiene un gas a 1,2 atm cuando su temperatura es de 298 K. Calcular la temperatura necesaria para bajar la presión a 1 atm.
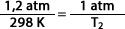
Despejando a T2

Ley de Avogadro
La ley de Avogadro establece que el volumen de un gas mantenido a temperatura y presión constantes es directamente proporcional al número de moles del gas presente, es decir, si se aumenta la cantidad de gas aumentará el volumen del mismo, y si disminuye la cantidad de gas, disminuirá el volumen del mismo.
La expresión matemática de esta Ley es:

Como se indicó anteriormente, un mol de cualquier gas contiene 6,02 . 1023 moléculas y en condiciones normales de presión y temperatura ocupa siempre el mismo volumen. Este volumen constante es denominado volumen molar, el cual es de 22,4 L.
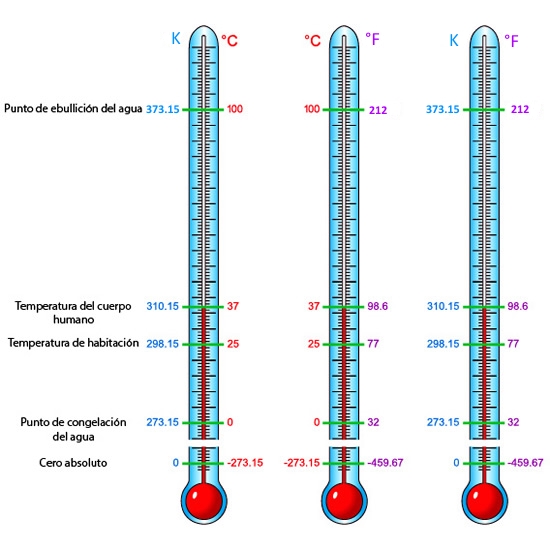
Temperatura absoluta
En 1848, lord William Thomson Kelvin sugirió que la energía de movimiento de las moléculas gaseosas era de cero a la temperatura de -273 °C, es decir a un volumen cero. Esa temperatura conocida como cero absoluto es inalcanzable, por lo que tuvo sentido entonces tomarla como origen de una escala de temperaturas denominada escala absoluta de temperatura o escala Kelvin. Por ello, al hacerse necesario trabajar con una temperatura en Kelvin cuando los datos son suministrados en grados centígrados, es necesario sumarle 273.
Leyes de los gases ideales
Las leyes que se han estudiado se cumplen cuando se trabaja a bajas presiones y temperaturas moderadas. Sin embargo, los gases reales no se comportan de esta manera, por lo que se utiliza el término gas ideal para aquel que se comporte estrictamente según las leyes de Boyle-Mariotte, de Charles y Gay-Lussac. Cuando estas leyes se combinan en una sola ecuación, se obtiene la denominada ecuación general de los gases ideales:
P . V = n . R . T
Donde la nueva constante de proporcionalidad se denomina R, constante universal de los gases ideales, que tiene el mismo valor para todas las sustancias gaseosas de 0,082057 atm. L/ mol. K. El valor numérico de R dependerá de las unidades en las que se trabajen las otras propiedades: P, V, T y n.

Referencias bibliográficas:
Cuerpo de redacción (1997). Mentor interactivo. Enciclopedia temática estudiantil. Editorial Océano. Barcelona, España. Pág: 136-138.
Cuerpo de redacción (1989). Atlas visual de la ciencia. Editorial Océano. Barcelona, España. Pág: 421-425.