 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS

La materia que nos rodea está compuesta de átomos, son las unidades más pequeñas de un elemento.

Al estudiar y analizar una sustancia homogénea podemos encontrar diferentes componentes.
¿Qué es la materia? Todo aquello que ocupa espacio y tiene masa. Un papel, un barco, un gato, un zapato, una manzana. Todo a nuestro alrededor está conformado por materia.
La materia es todo aquello que ocupa un lugar en el espacio, la cantidad de materia de un cuerpo depende de su masa. Por ejemplo: un libro ocupa un lugar en el espacio, se puede pesar y medir. La principal característica de la materia es presentar masa y volumen.
¿Y de qué se compone la materia? Si continuamos con el ejemplo del libro, la materia con la que se conforman los elementos del mismo (tapas, páginas) se compone de átomos. éstos son la unidad más pequeña de la materia, y no se pueden dividir a través de procesos químicos.

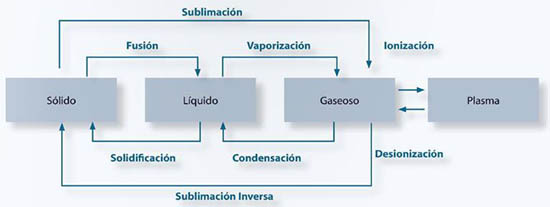
ESTADOS DE LA MATERIA
La materia puede presentarse de diversas formas. Sus propiedades ayudan a diferenciar las maneras en que se exhibe, todo depende de las condiciones en cada caso. Los estados de la misma son:
Formas en que se producen los cambios de estado en la materia:
PROPIEDADES DE LA MATERIA
Para poder estudiar la materia y sus propiedades, debemos tomar una parte de la misma en cualquiera de los estados anteriormente descriptos. Esta porción se denomina sistema material y presenta tanto propiedades extensivas como intensivas.

Un sistema material es una muestra que se toma de una sustancia para llevar adelante el análisis de sus propiedades.
Propiedades extensivas (extrínsecas o generales)
Dependen de la cantidad de materia, es decir, de la muestra que se haya tomado para el análisis. Si tomamos el ejemplo del agua, se podría tratar de una gota. Las propiedades generales son:
Longitud: Es la magnitud que mide la distancia entre dos puntos. Se puede medir con una regla, una cinta métrica, u otros dispositivos. Las unidades de medición corresponden al sistema métrico y la principal es el metro. También existen otras unidades como la pulgada, las millas y pies.
Volumen: Se trata del espacio que ocupa un cuerpo en el espacio, y es una magnitud derivada de la longitud ya que para calcularlo se multiplica su ancho por su largo y luego por su alto, es decir, las tres dimensiones.
La unidad de medida utilizada es el metro cúbico (m3).
Masa: Es la cantidad de materia contenida en determinado volumen y es la misma en cualquier parte del mundo, y también en otro planeta. Por ejemplo: Si tenemos 1 kg de hierro, su masa no variaría así estuviese en la Tierra o en Marte.
Para su medición se utilizan balanzas, y la unidad de medida son los kilogramos (kg) o las libras (lb).
Peso: Es la fuerza de gravedad de la Tierra sobre los cuerpos. Se diferencia de la masa ya que el peso no es el mismo en la Tierra que en otros planetas, mientras la masa se mantiene independientemente de las condiciones externas. Por ejemplo, una roca de 10 kg de masa pesará menos en la Luna ya que allí la fuerza de atracción es mucho menor.
Para calcular el peso de un objeto medimos su masa y la multiplicamos por la aceleración de la gravedad (9,8 m/s2 en la Tierra). La unidad de medida en el Sistema Internacional para el peso es N, newton.
Divisibilidad: Se trata de la propiedad que tiene un cuerpo de dividirse en pedazos más pequeños hasta convertirse en moléculas y átomos.
Inercia: La propiedad con la que un cuerpo conserva su estado de reposo o movimiento rectilíneo uniforme (MRU) a menos que una fuerza externa lo modifique.
Impenetrabilidad: Se trata de la resistencia que opone un cuerpo a que otro distinto ocupe su lugar en el espacio, mejor dicho, a ser traspasado. Es la imposibilidad de que el mismo espacio sea ocupado por dos cuerpos distintos al mismo tiempo.
Elasticidad: La capacidad que tienen los cuerpos de cambiar su forma cuando se les aplica una fuerza, y luego recuperar la forma original tan pronto desaparezca la fuerza aplicada. Tiene un límite, ya que si se sobrepasa, el cuerpo puede sufrir una deformación permanente o una fractura. En objetos como una hoja de papel o un cuchillo es muy notable esta particularidad. En el caso de otros como la porcelana o el vidrio, la elasticidad se manifiesta poco.

Las bandas elásticas tienen una gran capacidad de estirarse y luego volver a su forma original. Por ello, tienen elasticidad.
Propiedades intensivas (intrínsecas o específicas)
No dependen de la cantidad de materia, porque son valores que permanecen inalterables al subdividir el sistema material inicial. Siguiendo con el ejemplo del agua, no importa si se trata de una gota, un vaso o balde, las propiedades intensivas del agua son las mismas cualquiera sea la cantidad analizada.
Estas propiedades se definen por una determinada magnitud denominada constante física, y son estas condiciones las que caracterizan a una sustancia. Sus propiedades intensivas nos permiten identificarlas y diferenciarlas de otras.
Densidad: La densidad de una sustancia se relaciona con la cantidad de masa contenida en determinado volumen. Es el resultado de dos propiedades extensivas, pero da como resultado una propiedad intensiva.
Para calcular la densidad, se divide la masa entre el volumen. El resultado se puede expresar en kg/m3.
Puntos o temperaturas de ebullición y fusión: Es una propiedad independiente de la masa, pero no así de las condiciones externas. Por ejemplo, un kg o un gramo de agua entran en ebullición a 100ºC cuando la presión exterior es de 1 (una) atmósfera.
En un sistema líquido, se considera como punto de ebullición a la temperatura en la cual el vapor del líquido es igual a la presión del medio que lo rodea.

A través de la ebullición, el agua cambia de su estado líquido al gaseoso.
Por otro lado, el punto de fusión se refiere a la temperatura en la cual los estados sólido y líquido de una sustancia se encuentran en un equilibrio térmico.
Propiedades organolépticas: Son las propiedades físicas de un sistema material que se pueden percibir a través de los sentidos. Por ejemplo su olor, color, sabor y textura. Las mismas se mantienen independientemente de la cantidad de sustancia que se analice. Por ejemplo, si tenemos un gramo de agua y un kilo, el sabor será el mismo en ambos casos. También lo será su aroma y el hecho de ser incolora.

A través de nuestros sentidos, podemos percibir las propiedades organolépticas de un sistema material.
Propiedades químicas: Son aquellas que se manifiestan al alterar la estructura interna molecular de una sustancia al interactuar con otras. Como la reactividad química, la combustión, la oxidación y la reducción.
Conductividad térmica: Es una propiedad física de los materiales que mide su capacidad de conducir el calor. Esta conductividad es también la capacidad que tiene una sustancia de transferir la energía cinética de sus moléculas a otras adyacentes, o también a sustancias con las que no está en contacto. A mayor conductividad térmica, el material conducirá mejor el calor, de lo contrario será más aislante. La magnitud inversa a esta propiedad se denomina resistividad térmica y se trata de la capacidad de los materiales de oponerse al paso del calor.
La conductividad térmica se mide en vatios sobre kelvin por metro W/(K • m)
Calor específico: Es también una magnitud física que se define como la cantidad de calor que se le debe suministrar a la unidad de masa de determinada sustancia para elevar su temperatura en una unidad. Depende del valor de la temperatura inicial y se representa con la letra c (minúscula).
Presión: Es la propiedad física que mide la proyección de la fuerza en dirección perpendicular por unidad de superficie, y se utiliza para caracterizar cómo se aplica determinada fuerza resultante sobre una línea.
La unidad de medición en el Sistema Internacional de Medidas se denomina pascal (Pa), y es equivalente a una fuerza total de un newton actuando uniformemente sobre un metro cuadrado (m2).
Concentración: La mezcla homogénea entre un soluto y un disolvente da como resultado una disolución. A menos proporción de soluto disuelto, menos concentrada se encuentra la misma, y a mayor proporción, mas concentración. Si utilizamos como ejemplo un vaso de agua con sal totalmente disuelta, veremos que en una gota o en un litro encontraremos la misma concentración.
Esta propiedad se mide cuantitativamente, y las magnitudes comúnmente utilizadas son los porcentajes de soluto (como en el alcohol comercial de uso doméstico), la molaridad, la normalidad o parte por millón.
Coeficiente de Solubilidad: Es la cantidad de soluto que puede disolverse en una cantidad dada de solvente. Varía con la temperatura externa y depende de la naturaleza del soluto, del solvente y de la presión. Cuando se trata de una disolución de un sólido en agua, este coeficiente aumenta con la temperatura. En cambio si se trata de un gas, la solubilidad disminuye a medida que aumenta la temperatura.
Clasificación de sistemas materiales
Como anteriormente se detalló, en todo sistema material se pueden apreciar propiedades intrínsecas que son iguales en todas sus partes. Cada una de estas porciones homogéneas se denomina fase y puede estar constituida por una o más sustancias, denominadas componentes de un sistema material. Pueden clasificarse de la siguiente manera:

Pueden dividirse en homogéneos o heterogéneos según la composición del sistema:
- Sistema material homogéneo: Está constituido por una sola fase. De manera tal que cualquier porción del mismo que se estudie tendrá las mismas propiedades intensivas. En otras palabras, las propiedades intrínsecas se mantienen constantes en toda su masa.

- Sistema material heterogéneo: Está constituido por dos o más fases. Por ello, presenta propiedades intensivas distintas en sus diferentes partes. En algunos casos se pueden percibir límites de separación entre las regiones que lo componen. En otros casos a simple vista puede parecer uniforme, pero el análisis cuidadoso advierte diferencias.
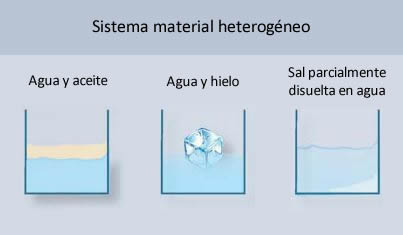

Para que el sistema sea homogéneo, es importante que la sal esté totalmente disuelta en el agua, de manera tal de que sea solo una fase.