 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
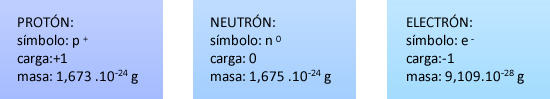
Las partículas subatómicas elementales son el protón, el neutrón y el electrón. Las dos primeras se encuentran en el núcleo del átomo y los electrones se ubican en zonas de probabilidad alrededor del mismo. También existen otras partículas. ¿Alguna vez escuchaste las palabras quark o neutrino y no sabes a qué se refieren? Aquí aprenderás eso y mucho más.

Los electrones pueden encontrarse en una zona de probabilidad denominada nube electrónica.
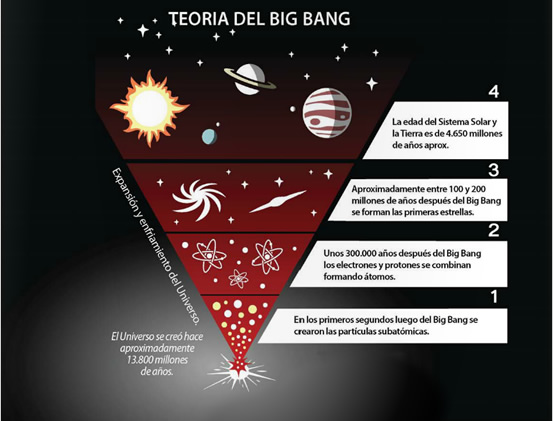
La materia está compuesta por átomos, éstos a su vez están formados por partículas subatómicas. La estructura atómica, como todos los descubrimientos científicos, es producto de un largo proceso de investigación y experimentación. La noción de átomo surge de los griegos: Leucipo de Mileto y Demócrito de Abdera, este último denominó átomo a la mínima porción de materia, utilizó dicha palabra porque su significado en griego es "indivisible". Las concepciones de estos dos pensadores griegos no prosperaron debido a que tuvieron una fuerte oposición por parte de los intelectuales de la época, como Aristóteles, quien sostenía que la materia era continua y solo cambiaba de forma. Fue John Dalton quien luego de veinte siglos retomó las ideas de Leucipo y Demócrito, sentando así las bases de la teoría atómica moderna.
A continuación podrás observar una línea de tiempo en la que conocerás cuándo y quién descubrió cada partícula subatómica.

Las formas de representar la estructura de los átomos han sido explicadas en los modelos atómicos. Con el paso del tiempo se han descubierto nuevas partículas y teorías acerca de la estructura atómica.
El mismo año en que Chadwick descubrió el neutrón, Carl David Anderson (1905-1991) identificó una nueva partícula: el positrón. También denominada antielectrón, tiene las características del electrón pero con carga positiva; no forma parte de la materia ordinaria porque puede producirse o desaparecer de acuerdo a ciertas condiciones, como las de transformaciones nucleares.

El positrón es la primera antipartícula descubierta.
Luego del positrón se descubrieron más de doscientas partículas, entre ellas los leptones y los hadrones.
Leptones: Su nombre proviene de la palabra "leptos" cuyo significado es pequeño. Son partículas cuya interacción es débil. Pueden desplazarse libremente y se encuentran seis tipos: electrones, neutrinos (tres clases) y muones (dos clases).
Electrones: Partículas con carga negativa, 2000 veces más pequeñas que los protones.
Neutrinos: Carece de energía, puede atravesar toneladas de material sin sufrir perturbaciones.
Nuestro cuerpo es atravesado de miles de millones de neutrinos por segundo.
Muones: Son partículas similares a los electrones, pero 200 veces más pesadas, que en microsegundos decaen en un electrón más dos neutrinos.
En 1975 se encontró otro leptón cargado, 3600 veces más pesado que el electrón, se lo denominó tau. Su vida media es muy pequeña.
Se cree que el muón y el tau existieron en los momentos iniciales del Big Bang, actualmente se encuentran en los rayos cósmicos y los aceleradores de partículas.
Hadrones: Son partículas pesadas formadas por otras: los quarks. Sus estructuras elementales son los bariones y mesones.
Quarks: Los protones y neutrones están formados por quarks. Éstos interactúan con las cuatro fuerzas fundamentales: interacción gravitatoria, interacción electromagnética, interacción nuclear fuerte e interacción nuclear débil. Son parte de la materia y se dividen en seis tipos: up, down, charm, strange, top y bottom.
PARTÍCULAS DE INTERACCIÓN:
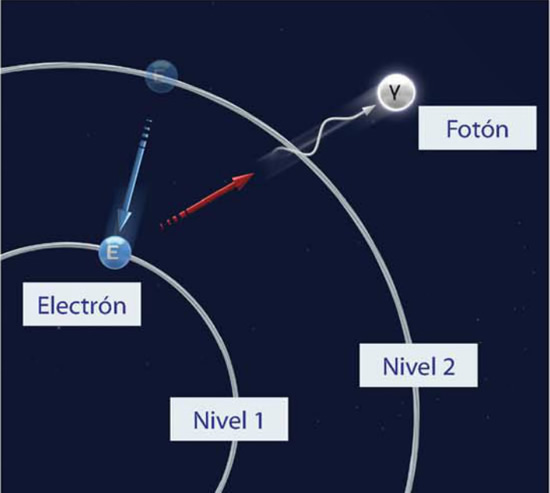
Emisión espontánea de un fotón.
Gluones: Su nombre proviene de la palabra inglesa "glue", que significa pegamento. Son portadores de la interacción fuerte entre quarks.
Piones: Mantienen unidos a los protones y los neutrones.
Fotones: Transportan interacción electromagnética, son portadores de las formas de radiación electromagnética, como la luz visible.

La luz infrarroja es una forma de radiación electromagnética.
¿Qué es el bosón de Higgs?
Un bosón es una partícula elemental o estado ligado de partículas elementales, definido por la estadística de Bose-Einstein.
El bosón de Higgs fue descubierto en el año 2012, había sido predicho por el físico Peter Higgs en 1964. Este descubrimiento contribuyó a la comprensión del universo y debido a eso Higgs recibió el Premio Nobel en 2013. Su hallazgo fue el fruto de años de investigación y con él se puede comprender un poco más acerca de la composición de la materia
ESTRUCTURA DE LA MATERIA:
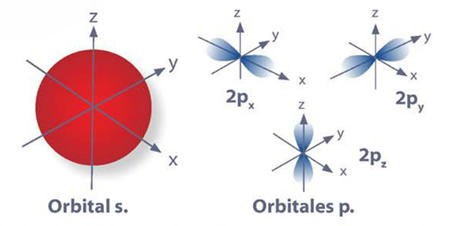
En el modelo atómico actual los postulados más importantes son la existencia de orbitales y de niveles de energía. Los orbitales son las zonas donde es más probable encontrar a los electrones, éstos se pueden hallar en la denominada nube electrónica. Existen orbitales s, p, d y f para los elementos en su estado fundamental.
En el núcleo del átomo se hallan los protones y neutrones y en la zona extra-nuclear los electrones, que giran alrededor del núcleo. Éste contiene la mayor cantidad de masa del átomo.
Un átomo neutro tiene la misma cantidad de protones que de electrones.
Composición de un átomo

Para conocer exactamente la cantidad de partículas subatómicas elementales que posee un átomo se deben conocer los conceptos de número atómico y número másico.
Número atómico: Se lo representa por la letra Z y corresponde a la cantidad de protones que tiene un átomo determinado. Los elementos están ordenados en la tabla periódica de acuerdo a su número atómico.
Un átomo neutro tiene la misma cantidad de protones que de electrones.
Número másico: Se lo representa por la letra A y se obtiene sumando la cantidad de protones y neutrones que se encuentran en el núcleo.
Número atómico = neutrones + protones
A = n0 + p+
A = n0 + Z
En el siguiente ejemplo podrás comprender cómo se compone un átomo:
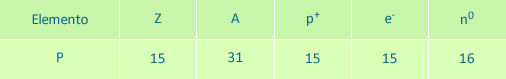
• Calcular la cantidad de protones, neutrones y electrones que tiene un átomo de Fósforo utilizando la tabla periódica.
Pasos de resolución:
1º Leer las referencias de la tabla periódica para identificar el A y el Z, ya que puede variar su ubicación de acuerdo a la tabla utilizada. Las formas más comunes de referencias son:

2º Extraer los datos que brinda la tabla periódica:
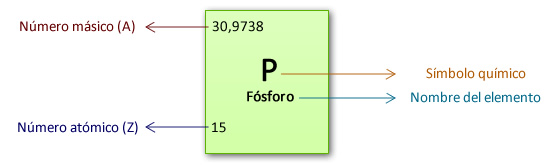
Z = 15 Siempre es un número entero.
A= 31 Se debe redondear el número, si luego de la coma hay un 5 o un número mayor se suma 1 al entero.
3º Hallar la cantidad de protones:
El número Z es la cantidad de protones, por lo tanto:
p+=15
4º Indicar el número de electrones:
En un átomo neutro el número de electrones es igual al número de protones por lo tanto:
e-=15
5º Hallar la cantidad de neutrones:
Con la fórmula A = n0 + p+ se calcula:
31 = n0 + 15
Despejando n0
n0 = 31 - 15 = 16
n0= 16
Entonces:
Configuración electrónica (C.E.)
Es la forma en la que se distribuyen los electrones en los niveles de energía. Existen 7 niveles de energía en los cuales se localizan los átomos conocidos y en cada uno de ellos puede ubicarse una cantidad limitada de electrones.
Cuando los electrones ocupan sus respectivos niveles de energía, el átomo está en su estado fundamental; en caso contrario, los electrones pueden saltar a niveles con mayor energía produciendo fenómenos como la fosforescencia y la fluorescencia.

Lámparas fluorescentes.
Existen reglas y principios para la distribución electrónica:
Principio de exclusión de Pauli: Cada orbital acepta como máximo 2 electrones, porque no pueden haber dos electrones con los 4 números cuánticos idénticos.
Principio de estabilidad: Los electrones se ubican en primer lugar en los orbitales con menor energía.
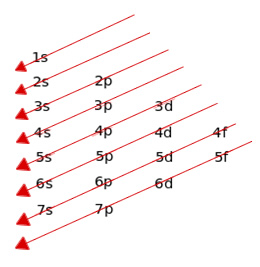
Regla de las diagonales: La regla de las diagonales indica el orden creciente de niveles de energía. El orden de llenado corresponde al sentido de las flechas.
Regla de Hund: Al llenar orbitales de igual energía (p, d y f) hay que tener en cuenta que los electrones desapareados (espines paralelos) poseen menos energía que los apareados (espines opuestos).