VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS

El agua es un compuesto químico de vital Importancia que brinda grandes beneficios para los seres vivos. Es la sustancia universal más abundante en la tierra, compuesta por hidrógeno y oxígeno.

HISTORIA DE LA MOLÉCULA DE AGUA
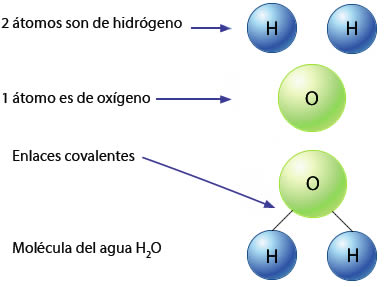
Antiguamente se creía que el agua era un elemento químico, actualmente se sabe que el agua es un compuesto formado por moléculas que a su vez están constituidas por dos átomos de hidrógeno y uno de oxígeno, quienes se unen mediante enlaces covalentes.
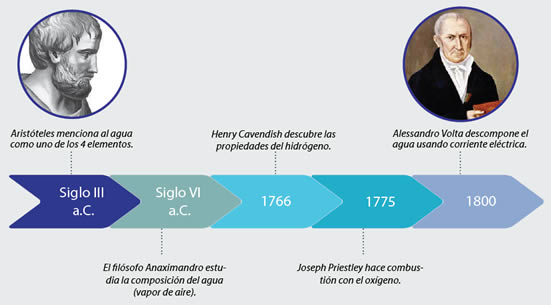
El filósofo griego Aristóteles fue el primero en considerar al agua como un elemento, de los cuatro que propuso: agua, fuego, tierra, y aire. Posteriormente, los filósofos como Anaxímenes descubrieron que el aire de la atmósfera estaba compuesto por vapor, pero, ¿de qué estaba compuesto ese vapor? Entonces develaron que era vapor de agua, se supo de ese modo que el agua podía estar en estado gaseoso.
Más adelante, el químico Henry Cavendish, en 1766, logró demostrar que el agua no es un elemento como se creía al principio, si no que era una molécula compuesta por dos tipos de "aire", el que tenía flogisto y el que no lo poseía. Se pensaba que el flogisto era una sustancia liberada por los compuestos químicos al aplicarles el proceso de combustión.
Luego, en 1775, el químico Joseph Priestley realizó experimentos que concluyeron en el descubrimiento del oxígeno. Actualmente sabemos que la molécula de agua se compone de la siguiente manera:
A continuación se presentará una línea de tiempo del estudio de la composición del agua:
GEOMETRÍA MOLECULAR DEL AGUA
El agua es un compuesto formado por la unión de dos elementos, oxígeno e hidrógeno mediante enlaces de tipo covalente. Las moléculas de agua se unen entre sí gracias a un tipo especial de enlace denominado puente de hidrógeno. El oxígeno posee seis electrones en sus orbitas externas, de los cuales tiene disponibles dos para formar dos enlaces covalentes (en este caso con los dos hidrógenos del agua) y los otros cuatro forman dos pares de electrones no apareados, de esta forma el oxígeno alcanza su octeto, siempre y cuando sus electrones libres se enlacen.
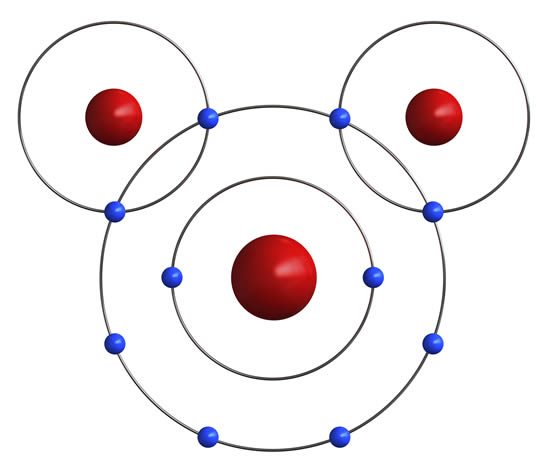
Los átomos de hidrógeno al unirse con 2 electrones del oxígeno forman el compuesto del agua.
En la molécula del agua la geometría molecular es angular, esto quiere decir que el ángulo entre los hidrógenos que forman el enlace covalente es de 104,5°.
GEOMETRÍA MOLECULAR DEL AGUA

PROPIEDADES FÍSICAS
El agua es un compuesto que en su estado natural puede encontrarse en 3 estados de agregación:

Los mares están formados por agua líquida con alto contenido de sales.

El hielo en las zonas polares suele flotar en agua líquida.

Las nubes se forman por la condensación del vapor de agua en la atmósfera.
PROPIEDADES QUÍMICAS
El agua al ser el solvente universal, puede unirse a infinidades de elementos y compuestos.
¿POR QUÉ ES TAN IMPORTANTE EL AGUA?
El agua es el principal solvente universal, pudiendo disolver muchas sustancias debido a la polaridad de enlaces, a excepción de grasas y aceites. También es más densa en estado líquido que en sólido, permitiendo la vida acuática. Además, por su alto calor específico es un buen regulador de temperatura.

El hielo en los glaciares al ser calentado por el calor del Sol, pasa a estado líquido.
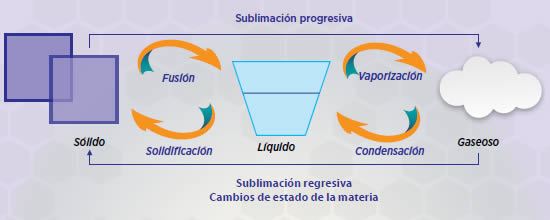
CAMBIOS FISICOQUÍMICOS DEL AGUA
El agua cambia de estado dependiendo de las condiciones de temperatura y presión que se le apliquen:
De sólido a líquido y líquido a sólido: El agua en estado sólido tiene un cambio de estado a cierta temperatura. Esta temperatura es denominada punto de fusión y el proceso es llamado fusión. Esta sustancia se funde a 0°C. El proceso inverso, de líquido a sólido se denomina solidificación.

El hielo en los glaciares al ser calentado por el calor del Sol, pasa a estado líquido.
De líquido a gaseoso y gaseoso a líquido: El agua en estado líquido al calentarse ebulle a una temperatura aproximada de 100°C, pasando a estado gaseoso o vapor de gas. Ejemplo de esto lo vemos al calentar agua en una olla, esta temperatura se denomina punto de ebullición. El proceso de cambio de estado de líquido a gaseoso se denomina evaporación. En el caso inverso, de vapor a líquido se denomina condensación. Esto lo vemos al hervir agua en una olla y al taparla, observamos que el vapor se condensa y se forman pequeñas gotitas, que podemos observar, por ejemplo, en la tapa.
De sólido a gaseoso y gaseoso a sólido: Este cambio es poco frecuente. Cuando el gas pasa a estado sólido es llamado sublimación regresiva, y cuando el cambio es viceversa se denominada sublimación progresiva. Ejemplo de esto lo vemos en el refrigerador, al abrir la puerta del congelador se observa que sale un vapor gaseoso, esto es el hielo que se sublima y pasa de estado sólido a gaseoso sin pasar por el estado líquido.
TENSIÓN SUPERFICIAL
Los líquidos como el agua poseen una propiedad que en estado gaseoso y sólido no la tienen, hablamos entonces de la tensión superficial, que forma como una película o barrera en la superficie del líquido, permitiendo la flotabilidad de algunos cuerpos y organismos más densos que el agua.
Las moléculas de agua en estado líquido se contraen unas con otras en distintas direcciones, sin embargo las moléculas que están en la superficie no, ya que al no haber moléculas por encima de ellas, sino a los lados, esa fuerza de atracción es mayor que la fuerza de interacción de las moléculas que están por debajo y esa fuerza intermolecular hace que se forme una película o capa que es resistente al movimiento de algunas partículas y organismos. Ejemplo de esto lo vemos cuando en el agua colocamos clips, una aguja, vemos algunos insectos flotar por encima del agua. Esta tensión es la responsable de la forma casi esférica de la gota del agua.

La tensión superficial permite la flotabilidad de los insectos.