 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
 La estequiometría calcula la cantidad de sustancia que hay en cualquier compuesto químico.
La estequiometría calcula la cantidad de sustancia que hay en cualquier compuesto químico.
 En los cambios físicos el producto final puede regresar a su estado original, como en el caso de fusión o derretimiento.
En los cambios físicos el producto final puede regresar a su estado original, como en el caso de fusión o derretimiento.
 1 mol de cobre (Cu) tiene 6,022 x 1023 moléculas y pesa 63,54 gramos.
1 mol de cobre (Cu) tiene 6,022 x 1023 moléculas y pesa 63,54 gramos.
 Un mol de H2O (agua) contiene 6,022 x 1023 moléculas y pesa 18 gramos.
Un mol de H2O (agua) contiene 6,022 x 1023 moléculas y pesa 18 gramos.
 La masa molar del nitrógeno es de 14,00674 gramos aproximadamente.
La masa molar del nitrógeno es de 14,00674 gramos aproximadamente.
 Antoine Lavoisier (1743-1794).
Antoine Lavoisier (1743-1794).
Todas las sustancias poseen elementos químicos que la conforman. Para saber exactamente la cantidad de electrones, protones, neutrones, iones y átomos que hay en cada compuesto surge la estequiometría.
Origen
Desde la antigüedad los químicos han estudiado la materia, pero sin saber la cantidad exacta de partículas que hay en ella. Las partículas son muy pequeñas y no visibles a simple vista, por ello era imposible contar la cantidad de iones, átomos y moléculas que formaban cierta sustancia. Se requería hallar un modo para medir la cantidad de sustancia.
Como la química es una ciencia cuantitativa, era necesario establecer una unidad de medida que facilitara los trabajos y cálculos en las investigaciones de la materia. Para esto, en el año 1896, el químico Wilhelm Ostwald propone el término ‘mol’ para referirse a la agrupación de partículas materiales (iones, átomos y moléculas). Pero recién en 1960 el mol es incluido dentro del Sistema Internacional de medidas como una de las siete unidades básicas y aceptado por la IUPAC (Unión Internacional de Química Pura y Aplicada).
Wilhelm Ostwald Wilhelm (Riga, 1853 – Grossbothen, 1932)
Filósofo y químico que obtuvo el Premio Nobel de química en 1909 por sus grandes aportes en el estudio del equilibrio en reacciones químicas y catálisis. Acuñó el término mol a la cantidad de las sustancias. Estudió también los colores en las sensaciones cromáticas al predecir la variación entre 4 colores básicos. Estudió las disociaciones de los electrolitos estableciendo la Ley de Ostwald.
Reacciones químicas y físicas
Las reacciones son muy comunes en la vida cotidiana. Una reacción es un proceso en el cual una o varias sustancias (reactivos) se convierten en otra u otras (productos).
Una forma sencilla de representar una reacción es la siguiente:
A + B  AB
AB
(Reactivos) Se transforman (Productos)
‘En las reacciones químicas los reactivos pueden combinarse para formar productos.’
Cambios químicos
Es sabido, quizás por experiencia propia, lo que le sucederá a un trozo de madera si le aplicamos fuego (se quemaría). Esto es un ejemplo de reacción química, donde la sustancia inicial se transforma y cambia completamente a un producto final diferente. En este caso la madera se transforma en gases y cenizas y es imposible volver a convertir esas cenizas en madera. Cuando esto pasa se dice que hubo un cambio químico en la estructura, siendo éste un proceso irreversible.

En las reacciones de combustión se producen cambios químicos en la materia, porque el producto final no puede regresar a su estado inicial.
Cambios físicos
Si ponemos a descongelar un trozo de hielo, el producto final sería agua en estado líquido, siendo diferente a la sustancia inicial (hielo sólido). El agua en estado líquido puede regresar a su estado de partida (hielo sólido) exponiéndola a bajas temperaturas. Cuando el producto puede regresar a su estado inicial se dice que es una reacción física, que es reversible.
Mol y número de Avogadro
El mol es una unidad del Sistema Internacional que sirve para medir la cantidad de sustancia.
En un mol hay muchos millones de átomos o moléculas (seiscientos dos mil trillones de átomos o moléculas), tanto que es algo difícil nombrar la cifra.
1 Mol = 6,022 x 1023 de átomos = Número de Avogadro
1 Mol = 6,022 x 1023 de moléculas = Número de Avogadro
El número de Avogadro, que nos indica la cantidad de átomos en un mol, siempre será el mismo: 6,022 x 1023. Lo que varía es la masa molecular del compuesto.
De toda materia que veamos a nuestro alrededor, podemos saber que 1 mol de cualquier sustancia tiene 6,022 x 1023 moléculas, pero diferente peso molecular:
| Sustancias | Fórmula | N° de moléculas | Masa mol molecular |
| Ácido benzónico | C6H5-COOH | 6,022 x 1023 | 122,11 g/mol |
| Dinitrógeno | N2 | 28,02 g/mol | |
| Dióxido de carbono | CO2 | 43,99 g/mol | |
| Butano | C4H10 | 58,14 g/mol |
Obsérvese en la tabla que la masa molecular es diferente en las 4 sustancias, aunque tengan el mismo número de moléculas (6,022 x 1023).
Masa molar: Es el peso en gramos o kilogramos de un mol de cualquier sustancia.
La masa atómica está descrita en la tabla periódica de los elementos, como el peso atómico.
Masa molecular: Es la suma de las masas de los elementos que conforman una molécula.
Por ejemplo, para calcular la masa molecular de un compuesto, la molécula del agua (H2O), seguimos los siguientes pasos:
1. Observamos la tabla periódica y ubicamos los elementos: hidrógeno y oxígeno.
2. De cada uno se debe obtener el peso atómico: hidrógeno = 1,007 y oxígeno = 15,999.
3. Redondeamos las cifras, en este caso a los enteros, y aproximamos: H = 1 y O = 16.
4. La fórmula H2O nos indica que hay 2 átomos de hidrógeno y 1 de oxígeno. Entonces:
Hidrógeno 2 x 1 = 2
Oxígeno 1 x 16 = 16
5. Se suman los pesos obtenidos:
2 + 16 = 18 gramos o unidades por cada mol.
Leyes estequiométricas
La estequiometría se rige por leyes. El químico Jeremias Benjamin Richter, propuso que:
"La estequiometría es la ciencia que mide las proporciones cuantitativas o relaciones de masa en la que los elementos químicos que están implicados".
Ley de la conservación de la materia: Fue propuesta por el químico y biólogo Antoine Lavoisier en 1785. Establece que la masa total de la sustancia inicial (reactivos) es igual al total de la masa final (productos). Es decir, que los reactivos a pesar de que se transforman en productos, no pierden ni crean masa, solo se transforman.
Ejemplo: Formación del ácido clorhídrico

Ley de las proporciones constantes: Fue propuesta por el químico Joseph Louis Proust en 1799. Establece que cuando dos o más elementos se unen entre sí para formar un producto, el compuesto final siempre tendrá la misma proporción ponderal, aunque sobren elementos que no se necesiten.
"Cuando dos o más elementos se combinan para formar un determinado compuesto lo hacen en una relación de masa invariable."
Ejemplo: Veamos la formación del sulfuro de plomo a partir de 4 átomos de plomo y 4 átomos de azufre. Si hay más átomos de plomo o de azufre de los 4 que se requieren, el producto siempre será el mismo (4 unidades de sulfuro de plomo), sobrando átomos innecesarios.

Ley de las proporciones múltiples: Fue propuesta por el químico John Dalton en 1808. Establece que cuando dos elementos se combinan entre sí dan lugar a varios productos, el peso del elemento y la masa del otro guardan una relación equivalente a números múltiplos.
"Si dos elementos forman más de un compuesto, las posibles masas de un elemento que se combinan con una masa fija del segundo elemento guardan entre sí una proporción sencilla de números enteros."
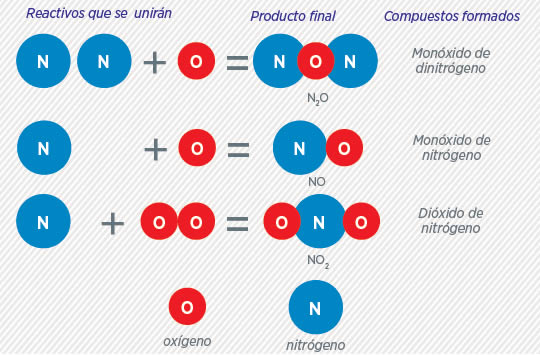
Ejemplo: Veamos la formación de compuestos a partir de dos reactivos, que serían átomos de nitrógeno y de oxígeno. La cantidad de átomos puede variar. Se forman diferentes compuestos a partir de los mismos átomos, lo que varía es la cantidad.
Ejercicios
Antes de realizar ejercicios es importante saber:
"Para realizar ejercicios de estequiometría se debe convertir de gramos a moles y viceversa, y de moles a átomos o moléculas o a la inversa.”
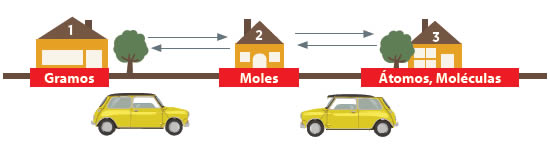
Imaginemos que gramos, moles y átomos son 3 casas que se comunican. Si en el ejercicio nos piden calcular cuántos átomos o moléculas tiene una muestra de 28 gramos de CO2, tenemos que convertir esas moléculas (casa 3) a moles (casa 2), y a partir de moles obtenemos los que se nos pide, que es gramos (casa 1). Lo mismo sucede en caso contrario.
EJERCICIO ESTEQUIOMÉTRICO CON UN ELEMENTO QUÍMICO
1. ¿A cuántos moles equivale una muestra de 7,43 g de Al (aluminio)?
Datos: 7,43 g de Al.
Masa atómica del aluminio: 26,98
Se procede a tomar la cantidad de gramos de aluminio y multiplicarlo por una fracción que se constituye por 1 mol del mismo elemento entre la masa molar. Esta fracción surge de una regla de tres:
26,98 g de Al _________________ 1 mol de Al
7,43 g de Al _________________ x

EJERCICIO ESTEQUIOMÉTRICO CON UNA MOLÉCULA
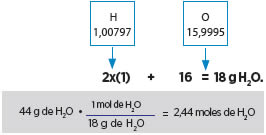
1. ¿Cuántas moléculas hay en una muestra de 44 g de H2O?
Datos:44 g de H2O
Moléculas: ¿?
Recordemos el ejemplo anterior de las 3 casas, a partir de 44 gramos (casa 1) pasaremos a mol (casa 2) y de mol a moléculas (casa 3). Por tanto debemos hacer una conversión. Tenemos que saber la masa molecular de dicha molécula:
Segunda conversión (de mol a moléculas): Una vez que pasamos de gramos a mol, usamos el valor resultante y lo multiplicamos por la cantidad de moléculas que posee un mol de H2O, o sea, el número de Avogadro (moléculas):
