 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Catálisis enzimática
En este tipo de catálisis, quienes actúan son las enzimas; proteínas con el papel de catalizador en reacciones de tipo bioquímico. Son numerosas en el metabolismo de los seres vivos. Este tipo de catalizadores biológicos se destacan por su alta eficacia.
Todo lo existente en el mundo es conocido como materia y ésta se caracteriza por poseer propiedades químicas. Cuando dos cuerpos externos interactúan entre sí ocurre una reacción, es decir, se altera el estado inicial o natural de los mismos. Esta alteración recibe el nombre de energía química.

La energía química es aquella que es liberada o absorbida en la formación de un enlace químico, es decir, se produce como consecuencia de una reacción química. Este tipo de energía es generada a partir de las interacciones entre átomos y moléculas. Todas las reacciones químicas absorben o generan calor, por lo tanto, siempre hay un intercambio de energía.
Reacciones endotérmicas
Las reacciones endotérmicas son aquellas que absorben calor, ocasionando de esta forma que la entalpía o energía final de los productos sea mayor que la energía inicial de los reactivos. En este tipo de reacciones la variación de la energía es positiva.
Estas reacciones forman enlaces y normalmente son anabólicas o de síntesis. Entre algunos de los ejemplos más comunes de reacciones endotérmicas se encuentran: la descomposición química del agua, la fotosíntesis de las plantas, la producción de ozono y la descomposición de las proteínas.

La fotosíntesis de las plantas es un ejemplo de reacción endotérmica.
Reacciones exotérmicas
Las reacciones exotérmicas son aquellas que liberan calor, lo que ocasiona que la entalpía o energía final de los productos sea menor que la energía inicial de los reactivos. En este tipo de reacciones la variación de la energía es negativa.
Estas reacciones liberan energía en forma de calor. Entre algunos de los ejemplos más comunes de reacciones exotérmicas están: la oxidación de los metales, la respiración de los seres vivos, la combustión de los compuestos orgánicos y la formación del amoniaco.

La oxidación de los metales es un ejemplo de reacción exotérmica.
Entalpía
La entalpía es la cantidad termodinámica que se utiliza para describir los cambios térmicos que se generan a presión constante, es decir, representa la medida de energía del sistema que está disponible en forma de calor. En el sistema internacional de unidades (S.I), la unidad de entalpía puede ser dada en kilocalorías (Kcal) o en Joule (J).
La entalpía se representa con el símbolo H. También se puede definir como el contenido de energía de cada sustancia participante en una reacción química y su variación en este sistema como el calor liberado o absorbido cuando una transformación ocurre a presión constante.
Factores que afectan la velocidad de una reacción química
Por ejemplo: una muestra de viruta de acero reacciona más rápido con ácido clorhídrico concentrado que con ácido clorhídrico diluido.

La temperatura es un factor principal que afecta las reacciones químicas.
Por ejemplo: algunos productos de limpieza contienen enzimas para facilitar la remoción de manchas y suciedades. Estas enzimas aceleran la separación de las moléculas de las sustancias responsables de generar las manchas en tejidos y superficies.
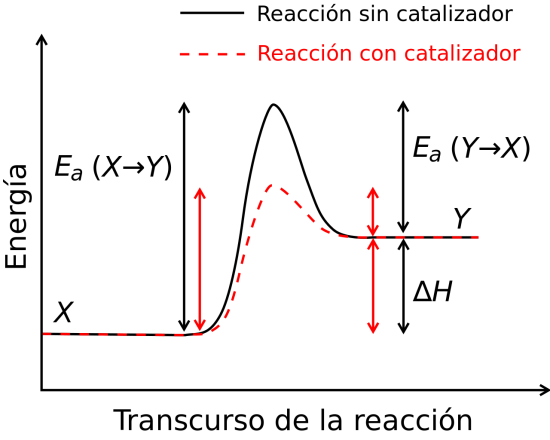
Efectos del uso de catalizadores en una reacción.
Por ejemplo: los antiácidos efervescentes cuando son triturados se disuelven más rápido en agua ya que la superficie de contacto aumenta y los hace reaccionar más rápidamente en el agua.