 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
¿Sabías qué?
Los productos de las reacciones de combustión son conocidos también como humos.
Existe una reacción química que en presencia del oxígeno libera energía calorífica y lumínica, a esta reacción se la conoce como combustión. A pesar de las numerosas aplicaciones que tienen las reacciones de combustión, muchas veces, causan serios daños en el medioambiente.
¿Qué es una reacción de combustión?
Una reacción química es un proceso en el que una o más sustancias sufren algún tipo de transformación tal como cambios en su estructura molecular o en sus enlaces. Incluso pueden transformarse en otras sustancias conocidas como productos.
Las reacciones de combustión son un tipo de reacción química en donde una sustancia o mezcla de sustancias combustibles liberan energía en forma de luz o calor en presencia del oxígeno.

Las reacciones de combustión se llevan a cabo de forma rápida.
Causas de la combustión
Una reacción de combustión se origina en presencia de un combustible, un comburente y una temperatura de inflamación adecuada.

La gasolina es el combustible empleado en mayor medida por los automóviles.
Forma general de la reacción de combustión
Debido a que el oxígeno presente en el aire es el comburente más usual, los siguientes ejemplos de reacciones de combustión suceden al estar en contacto con éste. Para plantear el proceso se tiene a un combustible que reacciona en presencia del aire para formar los productos correspondientes:
Combustible + Aire → Productos
De forma general se puede plantear de la siguiente manera:
aA + bB → cC + dD
Donde las letras que se encuentran en mayúsculas corresponden a las sustancias químicas de la reacción y las minúsculas corresponden a la cantidad de moles de dichas sustancias. A y B corresponden a las sustancias reactantes, es decir las sustancias que interactúan para dar lugar a otras sustancias conocidas como productos que en el caso de la ecuación corresponden a C y D.
Ejemplos de reacciones de combustión
1) Combustión del carbón mineral para obtener energía eléctrica:
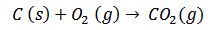
2) Combustión del metano, uno de los principales compuestos del gas natural que es empleado por muchas cocinas.
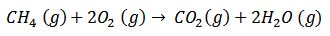
3) Combustión del etanol, compuesto utilizado como combustible.
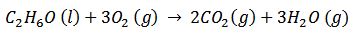
Otros ejemplos:
4) 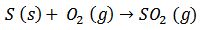
5) 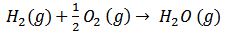
6) 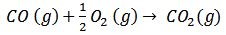
7) 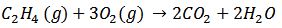
Combustión de hidrocarburos
Para hidrocarburos que presentan la forma general Cn H2n+2 conocidos como alcanos, existe una ecuación que permite balancear de forma sencilla la reacción de combustión:
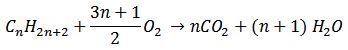
Para usarla simplemente se debe sustituir el número de carbonos del hidrocarburo (n) en la ecuación.
El metano es el alcano más simple.
Combustión biológica
En las células humanas (y de otros organismos) existe un momento en el que se retira la energía contenida en los alimentos ingeridos para emplearla en otros procesos biológicos. Este proceso se conoce como respiración celular, y consiste en una combustión biológica que puede compararse con la combustión del carbón o la leña pero de una forma más controlada. Por medio de esta combustión, las moléculas ricas de energías se transforman en moléculas más sencillas, lo que origina una liberación de energía.
A pesar de que la respiración celular y los otros tipos de combustión son reacciones exortémicas porque liberan energía, existen ciertas diferencias, por ejemplo, en la primera la liberación de energía se hace de forma paulatina, mientras que en las demás se hace de una forma rápida.
La respiración celular y la combustión son reacciones exotérmicas.
Importancia en la sociedad de las reacciones de combustión
La combustión es una reacción sumamente importante desde el punto de vista socioeconómico, ya que ha permitido lograr avances tecnológicos y favorecer la investigación. Los motores de combustión utilizados por muchos vehículos, las calderas industriales, los hornos domésticos y las centrales termoeléctricas son algunos ejemplos en los cuales se utiliza.

Por mucho tiempo los seres humanos han cocinado los alimentos a través de la combustión.
La combustión y el medio ambiente
El desarrollo humano y el ritmo de vida que lleva la sociedad actualmente, han provocado serios daños en el medioambiente, muchos de ellos como producto de las reacciones de combustión. El agotamiento de los combustibles fósiles, la contaminación, el aumento del efecto invernadero y el cambio climático se han ido acentuado en los últimos años como producto de la sobreexplotación de recursos y la industrialización.

La quema de combustibles fósiles provoca un aumento de la concentración del dióxido de carbono en la atmósfera, lo que incide en el efecto invernadero.