 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
La forma en que se distribuyen los electrones que conforman los enlaces de una molécula determina su polaridad, la cual a su vez influye en la intensidad y tipos de fuerzas intermoleculares que posee una sustancia, y por tanto, en sus propiedades físicas y químicas.
La polaridad es una propiedad de las moléculas que se manifiesta cuando existe una separación de cargas en las mismas, de manera que las moléculas polares son dipolos eléctricos que tienen un extremo positivo y otro negativo, en tanto las moléculas apolares no poseen dipolo eléctrico.

En las moléculas polares se utiliza el color rojo para representar las zonas parcialmente negativas (δ-) y el color azulpara las zonas parcialmente positivas (δ+).
El momento dipolar (µ) es la medida de polaridad de una molécula. En presencia de un campo eléctrico, las moléculas con momento dipolar diferente de cero se alinean en dirección al campo, en tanto, las moléculas apolares o con momento dipolar igual a cero no sufren cambios.
Una molécula está constituida por uno o más enlaces, los cuales pueden ser polares o apolares dependiendo de la electronegatividad de los átomos que conformen el enlace.
ELECTRONEGATIVIDAD
La electronegatividad es la capacidad que tiene un elemento para atraer electrones hacia sí. En la tabla periódica, la electronegatividad aumenta de izquierda a derecha en los periodos, y de abajo hacia arriba en los grupos, de manera que el elemento más electronegativo es el flúor.

Tabla periódica con electronegatividad.

POLARES VS. NO POLARES
Las fuerzas intermoleculares en moléculas apolares son más débiles respecto a las moléculas polares, es por ello que las sustancias apolares suelen tener puntos de ebullición y fusión más bajos.

¿Cómo saber si una molécula es polar o apolar?
En moléculas formadas por más de dos átomos, el momento dipolar es el resultado de la suma de las polaridades de cada uno de los enlaces que conforman la molécula, la geometría molecular es un factor determinante.
| CONOCE LAS GEOMETRÍAS MOLECULARES | ||
|---|---|---|
|
Tipo de geometría |
Representación |
Ejemplo |
|
Lineal |
|
Hidruro de berilio |
|
Angular |
|
Dióxido de azufre |
|
Tetraédrica |
|
Metano |
|
Pirámide trigonal |
|
Amoniaco |
La molécula de agua está formada por dos átomos de hidrógeno unidos a un átomo de oxígeno, que por ser más electronegativo atrae a los electrones, es decir, ambos enlaces se polarizan en dirección al oxígeno.
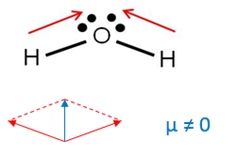
El agua es una molécula polar.
Debido a que el agua tiene una geometría angular, los vectores no se cancelan entre sí, por el contrario, se suman y dan como resultado un momento dipolar diferente de cero.
El dióxido de carbono es una molécula lineal formada por dos átomos de oxígeno unidos a un átomo de carbono, debido a que el oxígeno es más el electronegativo los enlaces se polarizan en dirección a este.
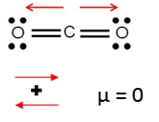
El dióxido de carbono es apolar.
Producto de la geometría molecular, los vectores dipolo tienen la misma magnitud pero sentido opuesto, por lo tanto, el momento dipolar de la molécula será igual a 0.
POLARES Y APOLARES A LA VEZ
Existen compuestos químicos que poseen en su estructura un extremo polar y otro apolar, por lo cual se denominan anfifílicos. El ejemplo más común de este tipo de moléculas son los fosfolípidos que conforman la membrana celular.
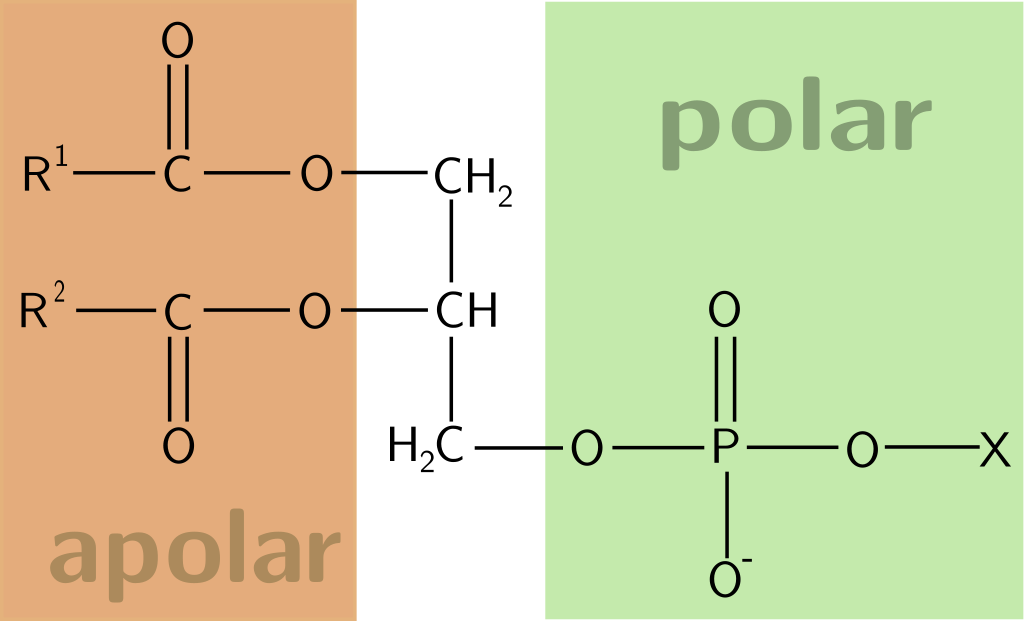
Estructura general de un fosfolípido.
Ejercicios
1) Ordena de forma creciente los siguientes elementos según su electronegatividad.
Cl, H, O, C, F, Pd, Na, Ca, Mn, Si y S.
2) Indica con una flecha hacia donde se polarizan los siguientes enlaces.
3) Predice la polaridad de las siguientes moléculas.