 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Gases disueltos en las gaseosas
El CO2 se mezcla con el líquido y son cerrados para mantener la presión del gas disuelto, de manera que existe un equilibrio entre la presión de vapor y el líquido interno, hasta el momento en el que se destapa el recipiente y el gas es liberado.

¿Sabías qué?
La olla a presión propició el desarrollo de aplicaciones para la ciencia, entre las que se destaca el autoclave, un equipo que permite la esterilización por acción de la temperatura.
Los plaguicidas, contaminantes
Los plaguicidas se evaporan con facilidad del agua y se dispersan en el ambiente, generando una contaminación considerable en la atmósfera.

¿Sabías qué?
Los anticongelantes son sustancias que al ser agregadas a ciertos líquidos provocan una disminución del punto de congelación.
La presión de vapor es el estado de equilibrio entre un líquido (o sólido) y su fase gaseosa. Existen múltiples aplicaciones en la vida cotidiana que aplican la variación del estado de la materia en función de la temperatura. Descubre todo sobre este tipo de interacción a continuación.

La presión de vapor se define como el cambio que presenta una sustancia en estado líquido o sólido al ser transformada en un gas. Describe la facilidad que presenta una sustancia para volatilizarse.
Cuando el recipiente contenedor es cerrado se aprecia un mejor equilibrio entre los estados de la materia. Por su parte, cuando el mismo es abierto, existe una interacción entre la sustancia y la atmósfera.

Equilibrio líquido – vapor en una disolución.
DEPENDENCIA DE LA TEMPERATURA
La presión es una propiedad que está influenciada por la acción de la temperatura, bajo una relación directamente proporcional, de manera que al aumentar la temperatura se incrementara el valor de la presión, de la misma forma al disminuir la temperatura también lo hará la presión.
FRACCIÓN MOLAR Y LA LEY DE RAOULT
La fracción molar (X) es una unidad de concentración que define la cantidad de moles de un compuesto A en relación a los moles totales de una disolución. Se define según la ecuación:
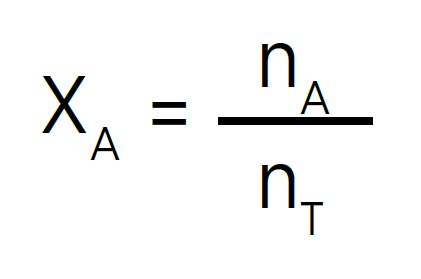
Dónde: XA es la fracción molar de A; nA representa los moles de A; nT son los moles totales de la disolución.
Los moles totales de la disolución se obtienen al sumar los moles de cada uno de los componentes de la misma.
La suma de las fracciones molares de los componentes de una disolución es igual a 1.
La ley de Raoult describe que la presión parcial de un compuesto (PA) en una disolución está definida por la relación que existe entre la presión de vapor del componente puro (PA°) y la fracción molar del mismo en la disolución (XA).
Está definida por la siguiente ecuación:
PA = PA°• XA
François Marie Raoult
Nació en mayo de 1830 en la ciudad de Fournes, en Francia. Raoult es el científico con más trabajos de investigación publicados en el siglo XIX, lo que le confiere el hecho de ser considerado el mejor químico experimental del siglo. Obtuvo la medalla Davy en el año 1892 por parte de la Royal Society de Londres. Murió en el sureste de Francia, en la ciudad de Grenoble en abril de 1901.

Una de las aplicaciones de la ley de Raoult es la separación de los compuestos puros presentes en una disolución por medio de la técnica de destilación, en la cual los componentes son separados por diferencia de temperatura.

Antiguo sistema de destilación.
Industrialmente el petróleo crudo se separa usando grandes equipos de destilación fraccionada, extrayendo los componentes de menor a mayor en relación al punto de ebullición: gas natural, gasolina, querosén, diésel y por último, el asfalto.

Refinería de petróleo.
LEY DE HENRY
La ley de Henry establece que a una temperatura constante, la concentración de un gas disuelto en líquido es proporcional a la presión parcial del gas en el líquido. En la ley de Henry la presión de vapor de una sustancia A, depende de la constante de Henry y la fracción molar del componente A en la disolución. Está definida por la siguiente ecuación:
PA = kh• XA
Debido a que cada sustancia presenta una volatilidad diferente, existe una constante que relaciona la facilidad que tiene una sustancia disuelta en agua de ser transformada en vapor y pasar a la atmósfera, la misma es conocida como la constante de Henry (kh).
CONSTANTE DE HENRY PARA GASES DISUELTOS EN AGUA A 20°C
| Sustancia gaseosa | Kh mol.L-1.atm-1 |
|---|---|
|
Hidrógeno |
8,5 x 10-4 |
|
Aire |
7,9 x 10-4 |
|
Nitrógeno |
7,0 x 10-4 |
|
Neón |
5,0 x 10-4 |
|
Argón |
1,5 x 10-3 |
|
Oxígeno |
1,3 x 10-3 |
|
Dióxido de carbono |
2,3 x 10-2 |
DISOLUCIONES REALES E IDEALES
Las disoluciones reales son aquellas en las que existe gran cantidad de interacciones
entre las moléculas que componen dicha disolución. Por otra parte, las ideales son aquellas en las que existe una mínima cantidad de interacciones, a razón de que las moléculas son similares.
Disolución ideal
Una disolución es ideal cuando cada uno de sus componentes cumple por completo la ley de Raoult en cada uno de los intervalos de concentración. Este tipo de disolución no implica una relación con los gases ideales.
La presión de vapor de una disolución ideal es igual a la suma de las presiones de vapor de sus componentes.
Los diagramas de presión de vapor vs. composición son aproximadamente similares entre las disoluciones reales y las ideales.
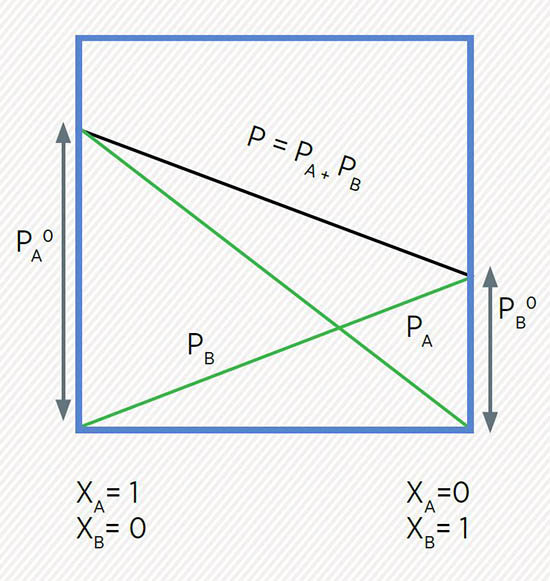
Diagrama de la presión de vapor de dos componentes en una disolución ideal.

El vapor de agua está en constante equilibrio con el líquido gracias a la presión de vapor.
PROPIEDADES COLIGATIVAS DE LA MATERIA
Las propiedades coligativas se definen como las propiedades que presenta una disolución en relación a la concentración. Cada una de ellas guarda una relación directa con la presión que ejerce el vapor sobre el líquido en un recipiente cerrado.
DISMINUCIÓN DE LA PRESIÓN DE VAPOR DE UN COMPONENTE
Los líquidos volátiles presentan una mayor presión de vapor, dado que las interacciones moleculares son pequeñas, lo que provoca que exista un equilibrio desplazado hacia el vapor. Mientras que en aquellos que presentan una mayor interacción molecular entre el soluto y el solvente, el equilibrio estará desplazado hacia el líquido y por tanto tendrá una menor presión de vapor.
La incorporación de un soluto no volátil a la disolución inicial provocará una disminución de la presión de vapor del componente A, ya que esta variable tiene una relación directa con la fracción molar XA.
El descenso de la presión de vapor es causado por la disminución de las moléculas del compuesto volátil en la superficie del líquido.
A medida que aumenta la concentración del componente no volátil, se observa un decaimiento de la presión de vapor en relación al componente puro, debido al aumento de las interacciones moleculares entre el soluto y el solvente, alterando el equilibrio entre el líquido y el vapor.
DESCENSO CRIOSCÓPICO
El punto de congelación de un líquido se define como la temperatura en la cual este pasa al estado sólido. El descenso crioscópico está relacionado directamente con la disminución de la presión de vapor, ya que al adicionar un soluto a la solución se provocará una mayor interacción entre las moléculas y por tanto la temperatura de congelación será menor en comparación a la de la solución inicial.
Inténtalo:
Toma dos envases y agrega la misma cantidad de hielo/agua en cada uno, al segundo vaso agrega 1 cucharadita de sal. ¿Qué ocurre? Con la ayuda de un termómetro toma la temperatura en los dos vasos. ¿Cuál es menor?
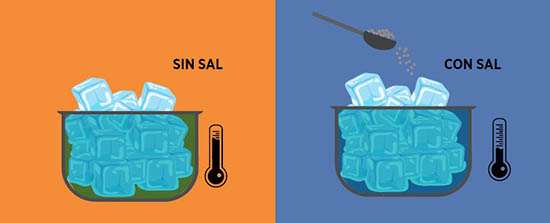
Al mezclar cloruro de sodio (sal común) con hielo, el punto de congelación disminuirá, provocando que el hielo se derrita rápido.
ELEVACIÓN EBULLOSCÓPICA
El punto de ebullición es la temperatura en la cual un líquido pasa a su estado de vapor. La adición de un soluto al líquido puro provocará una elevación ebulloscópica, debido a que al haber una mayor interacción entre las moléculas de una disolución será necesario aplicar una mayor energía para desplazar el equilibrio hacia el vapor.

La adición de un soluto aumenta la temperatura de ebullición.
El aumento de la temperatura de ebullición tiene una relación inversa con la presión de vapor, ya que un componente puro requiere menor temperatura para pasar de líquido a vapor.

La sal provoca una disminución del punto de congelación.
PRESIÓN OSMÓTICA
Es la presión que dirige el paso del disolvente desde la solución diluida a la concentrada, a fin de generar un equilibrio en función de la concentración.
Si dos disoluciones con diferente concentración están en contacto por medio de una membrana semipermeable el solvente pasará de la disolución más diluida a la más concentrada.
El digestivo de vapor: la olla a presión
Es un recipiente con cierre hermético, que al cerrarse impide la salida de vapor hasta el momento que se alcance la presión indicada previamente, por medio de una válvula reguladora. El aumento de la presión interna ocasiona una elevación marcada de la temperatura, de esta forma los alimentos se cocinan más rápido.
El invento data del año 1679, por parte del francés Denis Papín, éste era un colaborador del físico irlandés Robert Boyle, quien describió las leyes de los gases.
A pesar de las ventajas obtenidas por este nuevo invento que permitía cocinar alimentos más rápidamente, inicialmente resultó ser un fracaso pues la válvula de presión ocasiono diversos accidentes. Fue Napoleón Bonaparte quien en 1810 financió su modificación, la misma sufrió ciertos arreglos por parte de Nicholas Appert, quien obtuvo un producto con los mismos beneficios y mayor seguridad.

La olla a presión permite aumentar la temperatura más allá del punto de ebullición, pudiendo llegar hasta los 130 ºC.