 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
1.-OVARIOS
Los ovarios de teleósteos se caracterizan por estar ubicados debajo del riñón y la vejiga natatoria, suelen ser de forma tubular o laminar y con el extremo anterior algunas veces más redondeado, afinándose gradualmente hasta alcanzar el poro genital. Su coloración puede variar de amarillo-rosado a verde-amarillo, y en algunas fases de desarrollo, los ovocitos son visibles (Vazzoler, 1982); el tamaño y extensión de estos puede variar durante las diferentes fases de desarrollo, ocupando en algunos casos hasta el 70 % o más de su cavidad de celómica (Chaparro, 1994).
El ovario de los teleósteos es de tipo cistovárico, es decir, contiene un lumen (el ovocele) al cual se liberan los huevos durante la ovulación. En otras subclases de peces el ovario es de tipo gimnovárico, y se diferencia del anterior en que los ovocitos se liberan directamente a la cavidad peritoneal. A través del oviducto, los huevos (o larvas en el caso de las especies vivíparas) salen al exterior por el poro genital (Pinillos, 2003). Desde un punto de vista funcional y morfológico, la unidad básica del ovario es el folículo ovárico, cuya organización es similar en la mayoría de los teleósteos (Fig. 1).
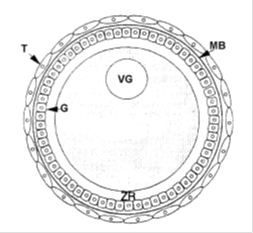
Figura 1. Diagrama general de un folículo desarrollado. El ovocito está rodeado por una capa acelular llamada zona radiada (ZR), y cubierta por la capa de células de la granulosa (G). La capa de las células de la teca (T), separada por una membrana basal (MB). Tomado de: Blancas (2007).
El desarrollo ovárico puede ser de tipo sincrónico, en el que todos los folículos se desarrollan de forma simultánea, encontrándose generalmente dos poblaciones de ovocitos en desarrollo; o asincrónico, en el que se observa una población heterogénea de folículos en distintos estadios. Hay que tener en cuenta que los términos asincrónico y sincrónico describen dos extremos de un proceso continuo y en los teleósteos existen todas las estrategias intermedias posibles (Pinillos, 2003).
Microscópicamente el ovocito tiene una ubicación central y está rodeado por una envoltura acelular denominada corion, zona radiata (Benavídes y col., 2006) o envoltura vitelina (Leino y col., 2005).
Esta envoltura se encuentra cubierta externamente por células foliculares, las cuales a medida que crece el ovocito incrementan su número, distribuyéndose en una envoltura continua de una monocapa de células (llamada granulosa) y una capa externa de células tecales o envoltura folicular externa. Ambas capas celulares se encuentran separadas por la membrana basal (Valdebenito y col., 2011).
El crecimiento ovocitario se caracteriza por ser un proceso complejo de desarrollo y de diferenciación que envuelve diferentes aspectos, como formación de numerosos nucléolos, desarrollo de cromosomas e inclusión de corpúsculos en los núcleos, acumulación de orgánulos de diversa morfología, RNA, e inclusiones en el ovoplasma y formación de varias envolturas (folículo) ovocitarias (Landínez, 2005).
En todas las especies de teleósteos estudiadas hasta la fecha, el desarrollo del ovocito sigue un patrón similar en el que se pueden distinguir las siguientes etapas consecutivas: ovogénesis, cromatina nucleolar, fase perinucleolar, alveolo cortical, vitelogénesis, maduración y ovulación (Bromage y Cumaranatunga, 1988). Si bien es cierto que al ser el crecimiento del ovocito un proceso continuo, los límites de algunas de estas fases se pueden superponer.
OVOGONIAS
Las ovogonias experimentan proliferación por divisiones mitóticas y se presentan distribuidas de una manera no uniforme, aisladas o formando cistos (Peredo y Sobarzo, 1993), con características celulares en función a la especie (Valdebenito y col., 2011).
CROMATINA NUCLEOLAR
Esta etapa comprende desde leptoteno a paquiteno de la profase I. Al microscopio óptico se observa una redistribucion de los cromosomas por todo el núcleo adoptando variadas figuras cromosomales, además de una redistribución de orgánulos citoplasmáticos. Durante esta etapa se observa el cuerpo vitelino de Balbiani o “núcleo vitelino”, compuesto por diversos orgánulos como retículo endoplásmico liso, aparato de Golgi, mitocondrias, gránulos lipídicos y cuerpos multivesiculares (Wallace y Selman, 1980).
FASE PERINUCLEOLAR
Esta fase debe su nombre a la migración de múltiples nucléolos hacia el nucleoplasma periférico, apareciendo la vesícula germinal. La vesícula está detenida en diploteno pero el crecimiento ovocitario y la diferenciación de la pared folicular continúa. Se observan las capa de la granulosa y de células tecales así como rudimentos del corion; el cuerpo de Balbiani está en posición yuxtanuclear (Takashima e Hibiya, 1995) (Fig. 2).
ALVÉOLO CORTICAL
Esta fase se define por la aparición de gotas lipídicas o avesículas vitelínicas, formando un alvéolo alrededor de la vesícula germinal, contribuyendo a un incremento de tamaño por parte del ovocito. Se mantiene el corion y se observan, además, microvellosidades (Takashima e Hibiya, 1995; Honji y col., 2006) (Fig.2).
VITELOGÉNESIS
Esta fase de crecimiento citoplasmático está representada por un incremento de los orgánulos citoplasmáticos, como son las mitocondrias, los cuerpos multivesiculares, el retículo endoplasmático y los elementos del aparato de Golgi (Valdebenito y col., 2011), por lo que el ovocito aumenta de tamaño considerablemente con respecto a las demás fases, incorporando materiales por micropinocitosis, ayudando a la formación de gránulos de vitelo que servirán como reservas para el desarrollo del organismo una vez fecundado (Fig. 2).
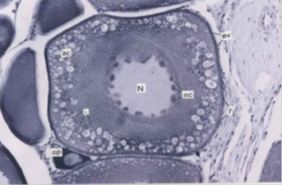
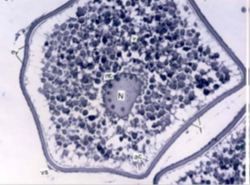
Figura 2. Ovocito perinuclear y alvéolo cortical (izq). Ovocito al final de la vitelogénesis (der). Tomado de: Saborido (2005).
MADURACIÓN
En esta fase se restablece la meiosis y por consiguiente la de la migración de la vesícula germinal hacia el polo animal y la posterior ruptura de ésta, el vitelo se clarifica por la hidratación del ovocito, ahora de mayor tamaño (De Nagahama, 1983; Zanuy y Carrillo, 1987; Takashima e Hibiya, 1995; Honji y col., 2006). La meiosis vuelve a detenerse en metafase de la segunda división (Takashima e Hibiya, 1995), para luego ser ovulado y eventualmente desovado (o puesto). El reinicio y finalización de la segunda división meiótica ocurre posterior a la fecundación del ovocito II (Fig.3).
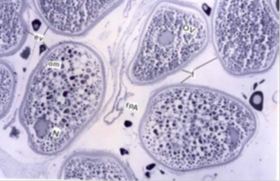
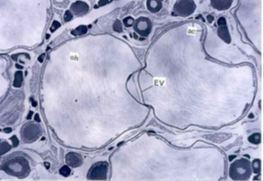 Figura 3. Ovocitos en el inicio de la maduración (izq). Ovocitos al final de la maduración (der). Tomado de: Saborido (2005).
Figura 3. Ovocitos en el inicio de la maduración (izq). Ovocitos al final de la maduración (der). Tomado de: Saborido (2005).
OVULACIÓN
La ovulación hace referencia a la liberación del huevo de su cubierta folicular y expulsión del mismo a la cavidad peritoneal o al lumen del ovario. Para que este proceso se realice se requiere, por un lado que el ovocito se separe de las células foliculares, por otro la formación de un orificio en las capas foliculares, y finalmente la expulsión activa del huevo a través de dicho orificio gracias a la contracción de las fibras de músculo liso situadas en la capa de las células de la teca (Pinillos, 2003).
2.-TESTÍCULOS
Los testículos se conectan al exterior a través del conducto deferente que llega hasta la papila genital. En función del modo de diferenciación del tejido germinal, en los peces se encuentran dos patrones de estructura testicular: lobular y tubular (Pinillos, 2003) (Fig. 4).
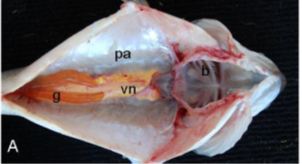
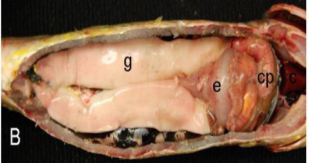
Figura 4. Tipos de estructura testicular en teleósteos. A- testículo tubular. B- testículo lobular. Tomado de: Gano y col, 2003.
El testículo lobular es el que presentan la mayoría de los teleósteos y está formado por túbulos, aunque debido a la variabilidad en su diámetro, en secciones histológicas, parecen lóbulos. Los túbulos están limitados por una membrana basal que divide al testículo en dos compartimentos, intertubular e intratubular. El testículo tubular por su parte presenta tubos ciegos orientados desde la periferia a una cavidad central en la que se liberan los espermatozoides (Gano y col, 2003).
Los testículos de teleósteos por lo general se caracterizan por ser pares, pero en algunas especies, estos pueden estar ubicados en un solo sáculo, (Benavides y col., 2005, De Nagahama, 1983), dando la apariencia de ser una sola gónada. Estos por lo general están suspendidos en la cavidad celómica por debajo del riñón y la vejiga natatoria (Chaparro, 1994). Su tamaño y color pueden variar de acuerdo al estadio de madurez sexual en que se encuentran, siendo por lo general translúcidos y con un peso equivalente al 2 % del peso del animal durante los primeros estadios de madurez, adquiriendo posteriormente una coloración un poco más intensa, que en el caso de los machos por lo general es blanco lechoso y en el de las hembras es amarillo rojizo, y un peso mucho mayor en estados avanzados de madurez gonadal (Benavides y col., 2005).
Desde el punto de vista de organización y diferenciación celular, el testículo presenta diversos cambios a lo largo del ciclo, pudiéndose identificar los diferentes estadios por el tamaño y localización de las células (Chaparro, 1994).
ESPERMATOGÉNESIS
La espermatogénesis es el proceso por el cual las células germinativas (espermatogonias) se convierten en espermatozoides, luego de una serie de cambios celulares ocurridos en los testículos. Las espermatogonias son células grandes y nucleadas que por división celular van a dar origen los espermatocitos (I, II), los cuales a su vez darán paso a las espermátidas, que finalmente originarán los espermatozoides en un proceso denominado espermiogénesis (Landínez, 2005) (Fig.5).
ESPERMIOGÉNESIS
En la espermiogénesis, que consiste en la reorganización del núcleo y citoplasma junto con el desarrollo del flagelo, la espermátida se transforma en espermatozoide. En la época de cría, y tras la ruptura de los espermatocitos, los espermatozoides son liberados al lumen del túbulo (Pinillos, 2003). Los testículos poseen en su interior una gran cantidad de estos túbulos, llamados conductos eferentes, que se comunican con el conducto deferente el cual termina en el poro genital situado dentro de la papila urogenital (Chaparro, 1994).
Tras liberar los espermatozoides al lumen, las células de Sertoli forman una barrera a lo largo de las paredes del túbulo, conocida como barrera hematotesticular, de forma que no hay un contacto directo entre los espermatozoides y el torrente sanguíneo. Esta barrera mantiene un microambiente favorable para la supervivencia de los espermatozoides. Las células de Sertoli, además de aportar a las células germinales un soporte, y permitir la formación de la barrera hematotesticular, también están implicadas en la fagocitosis de cuerpos residuales, en la secreción de sustancias nutritivas al lumen y en la esteroidogénesis testicular (Pinillos, 2003). En los espacios intersticiales se encuentran las células de Leydig, fibroblastos, vasos sanguíneos y linfáticos.
El testículo de tipo tubular es poco común, solo se encuentra en peces ateriformes y se caracteriza porque no presenta lumen. Las espermatogonias primarias se localizan al final ciego del tubo y, a medida que la espermatogénesis y la espermiogénesis tienen lugar, los espermatocitos van avanzando hacia los conductos deferentes (Pinillos, 2003).
Se observan entonces las siguientes fases:
INICIO DE LA ESPERMATOGÉNESIS
Hay renovación del epitelio germinal, en el túbulo se observa multiplicación de los cistos, aún no hay lumen. Proliferan las espermatogonias, que se dividen para originar los espermatocitos y posteriormente las espermátidas y los espermatozoides (Chaparro, 1994).
ESPERMIOGÉNESIS ACTIVA
Con un lumen lleno de espermatozoides y alrededor cistos con células en determinado grado de desarrollo; posteriormente los cistos son más pequeños y en el lumen aún hay espermatozoides (Chaparro, 1994).

Figura 5. Espermatogénesis paso a paso siguiendo el modelo anterior en el pez cebra (Danio rerio).
Tomado de: Schulz y col, 2010.
Referencias bibliográficas:
Benavides, L; Bolivar, A; Valdelamar, V. (2005). HABITOS ALIMENTARIOS Y BIOLOGÍA REPRODUCTIVA DE LA ARENCA (Triportheus magdalenae Steindachner, 1878) Y SU RELACIÓN CON LOS LÍPIDOS HEPÁTICOS, PROTEÍNA MUSCULAR, Y ALGUNAS VARIABLES FÍSICO - QUÍMICAS EN EL EMBALSE DEL GUÁJARO (Departamento del Atlántico).
Blancas, G. (2007). Desarrollo ovárico y su relación con los niveles hormonales circulantes de 17ß-estradiol y 17a-hidroxiprogesterona durante el primer ciclo reproductivo en hembras de pez blanco, Chirostoma humboldtianum Valenciennes (1835). Universidad Autónoma Metropolitana Unidad Iztapalapa. Mexico, 171 pp.
Bromage, N; Cumaranatunga, R. (1988). Egg production in the rainbow trout. In: Muir JF, Roberts RJ (eds). Recent advances in aquaculture. Blackwell Scientific Publications, Oxford, UK, Pp 64-138.
Chaparro, N. (1994). Reproducción artificial y manipulación genética en peces. Primera edición. Editorial Mejoras. Colombia, Barranquilla.
De Nagahama, Y. (1983). The functional morphology of teleost gonads. In Fish physiology, W. S. Hoar y D.J. Randall (eds.). pp. 223- 275.
Gano, G; Florenciano, A; López, O. (2003). GÓNADAS, VEJIGA NATATORIA Y RIÑONES DE LOS PECES. Anatomía Veterinaria, Facultad de Veterinaria, Universidad de Murcia.
Honji R, A Vaz-dos-Santos, CL Rossi-Wongtschowski. (2006). Identification of the stages of ovarian maturation of the Argentine hake Merluccius hubbsi Marini, 1933 (Teleostei: Merlucciidae): advantages and disadvantages of the use of the macroscopic an microscopic scales. Neotrop Ichthyol 4, 329-337
Landínez, A. (2005). MECANISMOS CELULARES DE LA REPRODUCCIÓN DE LOS PECES. Reproducción de los peces en el trópico. Bogotá, D. C. – Colombia.
Leino L, K Jensen, G Ankley. (2005). Gonadal histology and characteristic histopathology associated with endocrine disruption in the adult fathead minnow (Pimephales promelas). Environ Toxicol Pharmacol 19, 85-98.
Peredo S; Sobrazo C. (1993). Microestructura del ovario y ovogénesis en Galaxias maculatus (Jenyns, 1842). Biol Pesq 22, 23-32.
Pinillos, M. (2003). Esteroides sexuales en ciprínidos. Ciclo estacional, dinámica de liberación al agua, afinidad por las proteínas plasmáticas y sensibilidad olfatoria en la tenca (“tinca tinca”, l.). ISBN: 84-669-1713-6. Universidad Complutense de Madrid. 242 pp.
Saborido, P. (2005). Ecología de la reproducción y potencial reproductivo en las poblaciones de peces marinos. Instituto de Investigaciones Marinas (CSIC) Universidad de Vigo. Curso doctorado.
Schulz, R; França L; Lareyre, J; LeGac, F; Chiarini-Garcia H, Nobrega, R; Miura, T. (2010). Spermatogenesis in fish. General and Comparative Endocrinology 165 (2010) 390–411.
Takashima F, T Hibiya (1995). IX Gonads. In: Takashima F, Hibiya T (eds). An atlas of fish histology: Normal and Pathological Features. 2nd ed. Kodansha Ltd., Tokyo, Japan, Pp 128-153
Valdebenito, A; Paivaa, L; Berland, M. (2011). Atresia folicular en peces teleósteos: una revisión. Revisión bibliográfica. Arch Med Vet 43, 11-25 (2011)
Vazzoler, A. (1982). Manual de metodos para estudos biologicos de populacoes de peixes reproducao e crecimiento. Brasilia: CNPq. Programa Nacional de Zoología, 1982. p. 107.
Wallace,R; Selman, K. (1980). Oogenesis in Fundulus heteroclitus. II. The transition from vitellogenesis into maturation. Gen Comp Endocrinol 42, 345-354.
Zanuy S, M Carrillo. (1987). La reproducción de los peces teleósteos y su aplicación en acuicultura. En: Espinosa de los Monteros J, Labarta U (eds). Reproducción en acuicultura. CAICYT. Madrid, España, Pp 1-131.