 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
El cabello, la seda producida por insectos, la piel, el tejido conjuntivo, todos ellos están formados por proteínas fibrosas, las cuales se encargan de conservar la arquitectura celular y tisular en los animales.
QUERATINAS
El cabello, la lana, las uñas y parte de la piel estan formados por queratina, un grupo de proteínas que comprenden a la alfa-queratinas y las beta-queratinas, las cuales forman largas fibras que sirven de soporte tanto en el interior como en la superficie de muchas células.
La alfa-queratina es la proteína más estudiada dentro de las queratinas, llamada así porque contiene hélices alfa, la cual pertenece a una familia de proteínas helicoidales, denominadas de esta forma por la posición que adoptan en el espacio, representadas por el cabello y la lana. En la figura 1 se muestran los niveles de organización de la alfa-queratina para formar el cabello; pares de hélices proteicas se enrollan a izquierdas para formar una estructura de ovillo enrollado, un dímero de 50 nm, el cual se mantiene unido gracias a las fuerzas de Van der Waals y las interacciones iónicas de los aminoácidos que la componen, principalmente cisteína. La cantidad de puentes disulfuro formados por residuos de cisteína en la fibra (entre hélice y hélice) va a determinar el grado de elasticidad y flexibilidad de los tejidos, un ejemplo son las diferentes texturas de cabello que encontramos en la naturaleza; mientras más suave y flexible sea el pelo, menor es la cantidad de enlaces disulfuro en la fibra o de residuos de cisteína en la hélice, por ello en la industria cosmética los alisados de cabello se basan en productos que contienen compuestos químicos que rompen los enlaces disulfuro, eliminando así en cierto grado la rigidez de las fibras de cabello.

Figura 1. Organización de una fibra de alfa-queratina.
Tomado: Mathews y col (2004)
Las beta-queratinas están constituidas por cadenas de polipéptidos en forma de lámina plegada, presente en las plumas, las garras, los picos, las escamas, los cuernos y las uñas de reptiles, aves, y algunos mamíferos, donde la composición de aminoácidos determina la dureza, la resistencia y la flexibilidad de las mismas, y al igual que en las alfa-queratinas, modificando su resistencia mecánica por tratamientos con químicos, o por variaciones en factores ambientales como la humedad y la temperatura (calor).
FIBROÍNA
La tela de la araña y la seda que forman los capullos o pupas de polillas y muchas mariposas están formadas por una fibra resistente que posee cadenas de polipéptidos en lámina beta plegada, unidos por interacciones débiles de Van der Waals, lo que hace que al tocarlas se doblen fácilmente o se pierda la forma que tenían al inicio; adicionalmente poseen aminoácidos en ciertas regiones que no se ajustan a la lámina plegada y que probablemente estén relacionados a la elasticidad de las mismas, por lo que cuando se observa una tela de araña se aprecia el grado de extensión que estas adoptan, en este caso, para poseer una mayor área en donde puedan quedarse atrapados ciertos animales (Fig.2).

Figura 2. Organización de una fibra de fibroína.
Tomado de: Urdiales (2005).
COLÁGENO
El colágeno representa la proteína más abundante en los mamíferos y la mayoría de los vertebrados, siendo el esqueleto por el cual se mantienen unidos, formando la matriz de los huesos, tendones, dientes, cartílagos y piel.
Una fibra de colágeno está formada inicialmente por el tropocolágeno, el cual está constituido por una hélice de tres cadenas polipeptídicas enrolladas a izquierdas y unidas por interacciones de Van der Waals. La unión de varias moléculas de tropocolágeno forma la fibra de colágeno (Fig.3). Los enlaces de hidrógeno formados por lo residuos de prolina de las hélices, ahora llamados hidroxiprolina, tienen un papel muy importante en la estabilización de la estructura del colágeno, ya que la enzima que ayuda a la formación de dichos enlaces necesita vitamina C, por lo que en nuestra alimentación es necesario una dieta que contenga ácido ascórbico puesto que su ausencia induce a la no formación de estos enlaces y por lo tanto al debilitamiento y aparición de lesiones en la piel, encías y vasos sanguíneos (hemorragias), enfermedad conocida como escorbuto (Fig. 4).
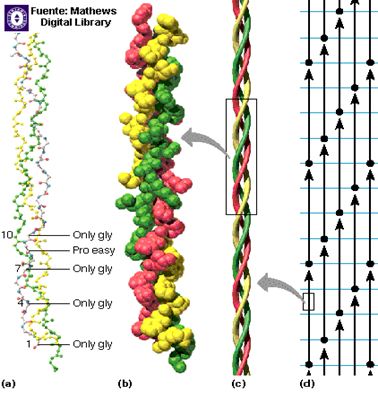
Figura 3. Organización de una fibra de colágeno.
Tomado: Mathews y col (2004)
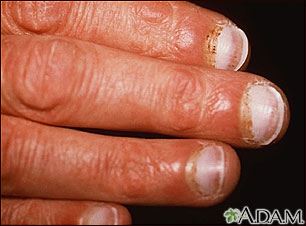
Figura 4. Escorbuto; hemorragia periungual.
Tomado de: MedlinePlus (2013)
Según las funciones del colágeno en los distintos animales se dan variaciones en la composición de los aminoácidos que forman a las hélices de la fibra, en concreto de la información genética de los organismos.
Por otra parte, el entrecruzamiento natural que se da entre las moléculas del protocolágeno está relacionado a la dureza y elasticidad de la piel, y por tanto, al envejecimiento celular, por lo que a mayor cantidad de entrecruzamientos y acumulación de los mismos, mayor será la rigidez y menor será la elasticidad de la piel y huesos de los animales; por ello los tratamientos con colágeno en la cosmética son muy conocidos para ayudar a tratar a las arrugas de la piel del rostro.
ELASTINA
En comparación al colágeno que genera un soporte rígido con poca elasticidad a los tejidos, la elastina aporta mayor elasticidad y flexibilidad necesaria para que el tejido conjuntivo, ligamentos y vasos sanguíneos arteriales puedan estirarse y contraerse con facilidad (Fig. 5).
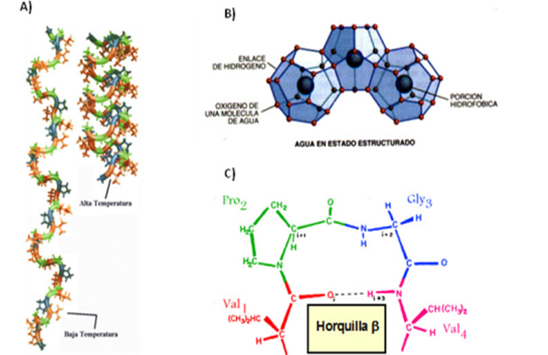
Figura 5. Niveles de organización de una fibra de elastina.
Tomado de: Fernández-Colino y col (2013)
La elastina se caracteriza por poseer en abundancia los aminoácidos valina, glicina y alanina, además de entrecruzamientos entre las cadenas polipeptídicas que están dispuestas en un ovillo aleatorio, lo que le confiere la capacidad de extenderse y volver a su estado anterior sin romperse, siendo la función de los entrecruzamientos en este caso, a diferencia del colágeno, la de mantener juntas a las cadenas que forman a la fibra de elastina.
Referencias bibliográficas:
Mathews, C; van Holde, K; Ahern, K. (2002). Bioquímica. (3a. ed). C.K. Pearson Educación S.A.
MedlinePlus. (2013). Un servicio de la Biblioteca Nacional de Medicina de EE.UU. Institutos Nacionales de la Salud. Consulta en línea: http://www.nlm.nih.gov/medlineplus/spanish/ency/esp_imagepages/2344.htm
Fernández-Colino, A; Girotti, A; López, M; Arias, F; Rodríguez-Cabello, J; Bioforge, G. (2011). Los polímeros tipo elastina y su utilización como tags para la purificación de proteínas. Universidad de Valladolid, Centro de I+D. Biomecánica, Vol.19, 2011, pp 8-16