 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS

En nuestra vida cotidiana entramos en contacto con diversidad de objetos; algunos son sólidos, otros líquidos y otros ni siquiera los podemos tener en nuestras manos porque son gaseosos. Si bien parece que todos son diferentes, podemos decir que hay algo que tienen en común: todos se forman de materia. Y… ¿De qué se forma la materia?
El elemento más pequeño que conforma a la materia es el átomo; en la naturaleza los átomos se combinan formando moléculas y las moléculas se combinan para formar sustancias puras o mezclas y dar lugar a la materia. Para entender mejor esto, analicemos el agua.
 |
Si observamos el agua bajo un microscopio, advertiríamos algo similar a la primera imagen. Cada una de las pelotitas representa un átomo. Cuando dos átomos de hidrógeno se juntan con uno de oxigeno, nos encontramos con una molécula de agua. Por eso en la segunda imagen se observa la inscripción H2O. Por último, hay que saber que muchas moléculas constituyen sustancias puras o mezclas. |
| El STM (microscopio de efecto túnel) es un instrumento mediante el cual se puede revelar la estructura atómica de las partículas, escanea el objeto de estudio y genera una imagen en tres dimensiones. Como resultado de este procedimiento se pueden distinguir moléculas y átomos. Funciona mediante técnicas de barrido de túnel, las cuales utilizan a la mecánica cuántica como herramienta teórica y se basan en la captación de los electrones que escapan de ese efecto túnel. Este dispositivo pertenece al campo de la nanotecnología, ya que permite analizar fenómenos a escalas nanométricas. |
Las sustancias puras son aquellas cuyos componentes no pueden separarse mediante procesos físicos; en algunos casos solo es posible mediante procesos químicos. El agua es una sustancia pura, si la analizamos en forma sólida (hielo), líquida o gaseosa (vapor), descubriríamos que su composición es la misma en todos los estados. Si la calentamos, la enfriamos o congelamos (todos estos son procesos físicos) siempre tendremos los mismos componentes: H2O. Tan solo lograremos obtener a partir del agua dos sustancias diferentes si aplicamos procesos químicos como la electrólisis que consiste en hacer pasar la corriente eléctrica por un recipiente con agua para recoger, por un lado, el hidrógeno y, por el otro, el oxígeno.
Si decidimos investigar sobre la composición del agua de mar, detectaríamos que también hay sal. Esto nos indica que el agua de mar no es una sustancia pura, pues es una mezcla de agua y sal la cual podemos separar mediante un proceso físico (evaporación).
| Proceso físico: son los cambios que no generan modificaciones en la composición de la sustancia. Son cambios reversibles, no ocurren cambios de energía y se detectan por observación o por medición. A través de estos procesos no se originan nuevas sustancias. Ejemplo: doblar o torcer un alambre. |
| Proceso químico: son el conjunto de transformaciones químicas y físicas destinadas a generar un producto final (manufacturado o no), distinto al inicial. Ejemplo: quemar un papel. |
Sustancias puras: elementos químicos y compuestos químicos
Dijimos que la materia se define como “sustancia pura” cuando no existe ningún procedimiento físico que nos permita separar sus componentes. A partir de esto, podemos inferir que existen sustancias puras formadas por una sola sustancia o más.
Cuando nos encontramos con una materia formada por moléculas con átomos diferentes en masa y propiedades, le llamamos compuesto químico. Es el caso del agua (H2O) que se compone de moléculas formadas por dos átomos de hidrógeno y uno de oxígeno.
Mezclas: homogéneas y heterogéneas
Las mezclas se definen como un sistema material formado por dos o más sustancias puras no combinadas químicamente. Se las clasifica en homogéneas y heterogéneas. En las primeras la composición es uniforme, a simple vista observamos un solo componente, sin embargo esa materia está formada por más de un componente. Las mezclas heterogéneas poseen una composición no uniforme la cual es fácil de distinguir.
Veamos un ejemplo:


Aquí tenemos dos bebidas que suelen tomarse en los días de calor:
¿Cómo separar sustancias puras?
Es imposible separarlas mediante procedimientos físicos porque solo están compuestas por un tipo de sustancia. No obstante, podemos obtener sustancias diferentes a partir de una sustancia pura. Para esto, debemos aplicar procedimientos químicos de descomposición.
Veamos en ejemplo: el caso del agua.
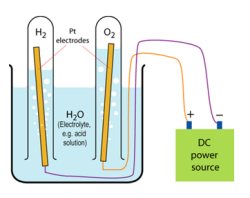 |
Electrólisis: dos electrodos se conectan a una fuente de energía y se insertan dentro del agua. El hidrógeno aparecerá como burbujas en el cátodo (el electrodo conectado al polo negativo) y el oxígeno aparecerá como burbujas en el ánodo (el electrodo conectado al polo positivo). |
Si hacemos pasar una corriente eléctrica por el agua, en presencia de una pequeña cantidad de otra sustancia que la haga conductora, puede descomponerse en dos sustancias: hidrógeno y oxigeno. Este proceso químico se llama electrólisis.
Hay que tener en cuenta que las moléculas de hidrógeno, de oxígeno, e incluso los metales, como el hierro, no se pueden descomponer en otras sustancias. Pero el agua es una sustancia pura compuesta que nos permite obtener otras sustancias; en tanto, el oxígeno, el hidrógeno y los metales, son sustancias puras simples.
¿Cómo separar mezclas?
Mezclas homogéneas
Al ver una mezcla homogénea parece imposible que se puedan separar sus componentes, sin embargo, existen métodos que permiten lograrlo.
Destilación simple: se utiliza este método cuando se necesita separar una solución de uno o más sólidos disueltos en un líquido, o dos líquidos con puntos de ebullición muy diferentes. El método consiste en emplear un aparato de destilación simple. En primer lugar, se coloca la solución en un balón de vidrio para que sea calentado. Ese balón está conectado a un tubo refrigerante, por el cual pasará el vapor que provocará el líquido al calentarse. Allí se condensará el vapor que será depositado en otro recipiente. El sólido o el líquido de mayor punto de ebullición queda en el balón.
 |
La destilación simple sirve para la separación de una mezcla homogénea de sólido y líquido como la de agua y cloruro de sodio. |
Destilación fraccionada: se utiliza cuando se necesita separar una solución formada por dos líquidos de punto de ebullición muy cercanos. En la industria se emplea la destilación fraccionada para la fabricación de bebidas alcohólicas, la obtención de agua destilada y el fraccionamiento de los componentes del petróleo. Este método de separación de mezclas, emplea un alambique compuesto de tres partes: un recipiente en donde se calienta el material que se va a destilar, una parte fría para condensar el vapor producido, o condensador, y un recipiente para recolectar el líquido.
Cristalización: sirve para separar una solución compuesta por uno o más sólidos de un líquido. Se calienta el sistema, en un recipiente llamado cristalizador, hasta que el líquido se evapore. El sólido quedará en el cristalizador y el líquido se perderá.
Cromatografía: se utiliza para separar fluidos, que pueden ser gases o líquidos. Este método de separación requiere de dos fases, una llamada fase móvil y la otra llamada fase fija o fase estacionaria. Las sustancias presentes en una mezcla son arrastradas a través de la fase estacionaria por la fase móvil, que puede ser una mezcla de alcohol y agua.
La fase estacionaria puede ser un sólido poroso como la celulosa presente por ejemplo en el papel secante, o como el gel. Las moléculas de menor tamaño que están presentes en las mezclas, pueden ingresar en todos los poros del papel (fase estacionaria) e invierten más tiempo en el recorrido mientras que las moléculas mayores de la mezcla, debido a su tamaño, no pueden ingresar en los poros que son más pequeños que ellas y emergen, de esta manera, más rápidamente. Por lo tanto, este método de separación se basa en las distintas velocidades con las que las sustancias pueden migrar, es decir, viajar a través de la fase estacionaria, dependiendo del tamaño de sus moléculas.
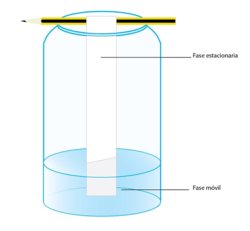 |
Esquema general de los componentes de una cromatografía. El papel es la fase estacionaria y el líquido la fase móvil. |
Mezclas heterogéneas
Por medio de diferentes métodos de separación de fases se puede separar una mezcla heterogénea. Algunos de ellos son: la decantación, la tamización, la filtración, etc. Se llaman métodos mecánicos a aquellos que no producen transformaciones en los componentes de la mezcla, es decir, que no provocan cambios de estado ni de tamaño de las partículas de cada fase.
Utilizar uno u otro método de separación depende de las propiedades físicas de los componentes de la mezcla, como la diferencia de tamaño entre sus partículas, la capacidad de ser atraídos por un imán (magnetismo) y la densidad, entre otras.
Tamización: sirve para separar componentes sólidos, de diferente tamaño, que se encuentran mezclados entre sí. El tamiz es una rejilla metálica que deja pasar los componentes más pequeños y atrapa los más grandes.
 |
En la siguiente imagen vemos el tamiz de un jardinero que lo utiliza para separar las piedras y la basura de la tierra. |
Centrifugación: es una técnica que se emplea para precipitar un sólido suspendido en un líquido. Se necesita una centrífuga, que es un instrumento que al girar genera una fuerza, la cual empuja el sólido al fondo del tubo. Al cabo de un tiempo se retiran los tubos, y el líquido se puede volcar o tomar con un gotero.
Levigación: es el famoso procedimiento que emplean los buscadores de oro. Consiste en hacer pasar una corriente de agua por una mezcla de diferentes sólidos no solubles en ella, así, son arrastrados los componentes más livianos y quedan en el plato los de mayor peso. Una variante de esta técnica es la de utilizar viento en vez de agua, en este caso al método se lo denomina ventilación.
Decantación: sirve para separar dos o más líquidos que no son solubles entre sí y que además poseen diferentes densidades, como el agua y el aceite. Para este procedimiento se emplea una ampolla de decantación. Este dispositivo consta de un robinete (llave) que se abre para dejar pasar el líquido que se ubica en la parte inferior de la ampolla. Una vez separado, se cierra el robinete y ambos líquidos se ubican en recipientes separados. Otra manera de realizar la decantación es a pulso. Para ello, se inclina suavemente el vaso de precipitados y con la ayuda de una varilla de vidrio se deja caer el líquido en otro vaso, sin que caiga el sólido del fondo.
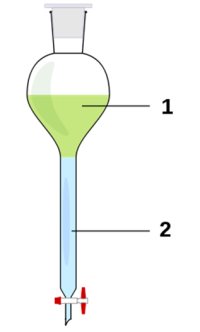 |
Ampolla de decantación |
Filtración: se recurre a este método para separar un sólido suspendido en un líquido, como el agua y la arcilla. Para esto hay que utilizar una barrera, que puede ser un material poroso como el papel de filtro, etc. Se hace pasar la mezcla por la placa que tiene poros para que el líquido se escurra y el sólido sea retenido.
Imantación: se usa cuando una de las fases de la mezcla está compuesta por sustancias con propiedades magnéticas. Consiste en el empleo de un imán para separar un componente con propiedades magnéticas, como el hierro o aleaciones que lo contengan, de otros no magnéticos. Es un procedimiento muy utilizado en el reciclado del acero.