 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS

Para un cambio de estado a presión constante la formulación de la primera ley de la termodinámica se convierte en:
dU = dQp - pdV
Donde U es la energía interna, Qp es el calor, p la presión y V el volumen. Dado que p es constante, de la integración resulta:
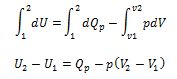
Reordenando, se obtiene:
(U2 + pV2) - (U1 + pV1) = Qp
La función U + pV, que es un combinación de variables de estado, es en sí misma una variable de estado, H. Definimos
H ≡ U + pV
H, se denomina entalpía del sistema, una propiedad extensiva de estado. Utilizando la definición de H puede expresarse la ecuación como H2 - H2 = Qp o bien:
ΔH = Qp
Para un cambio infinitesimal en el estado de un sistema, la ecuación anterior toma la forma;
dH = dQp
Como H es una función de estado, dH es una diferencial exacta. Escogiendo T y p como variables convenientes de H, la diferencial total puede expresarse como:
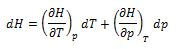
Para una trasformación a presión constante, es decir: dp = 0, la ecuación anterior, se convierte en dH = (∂H/∂T)pdT. Combinando esta expresión con la ecuación (7), se obtiene:
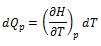
Que relaciona el calor transferido desde el entorno con el aumento de la temperatura del sistema. La razón dQp/dT = Cp, la capacidad calorífica del sistema a presión constante. Por consiguiente se tiene:
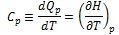
Que identifica la importante derivada parcial (∂H/∂T)p con la cantidad medible Cp. En lo sucesivo, la diferencial total en la ecuación (10), se expresará de la forma:
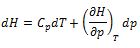
Para cualquier transformación a presión constante, como dp = 0, la ecuacion siguiente se reduce a:
dH = CpdT
O, para un cambio finito de estado de T1 a T2:
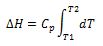
Si Cp es constante en el intervalo de temperatura que nos interesa, la ecuación anterior, se convierte en:
ΔH = CpΔT
No es posible medir la entalpía en un momento determinado, lo que por otra parte carece de importancia, pues lo que realmente interesa en una transformación no es la entalpía inicial y final del sistema, sino la variación de dicha magnitud a lo largo del proceso. El calor de transformación en cualquier cambio de fase es, por lo tanto, igual la diferencia entre las entalpías del sistema en las dos fases, en cualquier proceso isobárico reversible el calor absorbido es igual al cambio en la entalpía.
