 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS

Al observar nuestro entorno podemos apreciar la gran variedad de objetos de diferentes formas, tamaños, colores, comenzando por los seres vivos, animales, plantas, hongos, hasta pasar a los objetos inanimados, como una silla, una cocina, una casa, entre otros; teniendo dichos objetos algo en común, y es que todo lo que se observa, ocupa un lugar en el espacio y se ve afectado por las fuerzas gravitatorias, es lo que se conoce como la materia.
La materia está formada por millones de unidades básicas conocidas como moléculas, las cuales están unidas entre sí, y en donde el grado de unión o separación determinará las propiedades físicas y químicas de las mismas; es por ello que dichas propiedades se usan para la identificación y diferenciación de la materia. Un ejemplo se tiene al observar y comparar una telaraña, un trozo de tela hecha de nylon y un trozo de madera, en los tres casos las moléculas de los materiales tienen diferentes grados de separación o unión, lo que se trasmite a una propiedad física, como la elasticidad, la cual disminuye de la telaraña al trozo de madera.
Dentro de las propiedades físicas de la materia, se destacan los estados físicos, como sólido, líquido y gaseoso; el punto de fusión, de congelación, de ebullición, el olor, color y sabor, lo que significa la identidad del material. Lo que determina la capacidad de transformarse en otro material, son las propiedades químicas de la materia, como la alcalinidad, salinidad y acidez.
PROPIEDADES Y CAMBIOS FÍSICOS DE LA MATERIA
• Estado sólido: la materia sólida se define por ser de forma y volumen constante, siempre que no se ejerza una fuerza que afecte su estructura. Las moléculas de los sólidos están muy unidas entre sí, es decir, muy cohesionadas, por lo que dichas moléculas apenas pueden moverse, y su posición en el espacio es constante (Figura 1). Ejemplo de ello, se observan características propias que los diferencian de los líquidos y los gases
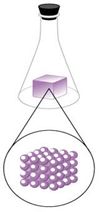
Figura 1. Estado sólido.
Tomado de: http://www.cambioplanetario.com/t4406-los-siete-estados-de-la-materia
Con experimentos en casa se pueden estudiar las propiedades de los sólidos, como la dureza y la tenacidad. Al rayar un bloque de barro y un vaso de vidrio, se observa que el barro se raya con mayor facilidad que el vidrio, característica de un sólido blando y uno duro, respectivamente; ahora, si se toma ese vaso de vidrio y una cuchara de acero inoxidable y se tratan de deformar, el vidrio se quebrará fácilmente mientras que a la cuchara se le tendrá que aplicar una mayor fuerza para deformarla, característica de un sólido frágil y tenaz, respectivamente.
En la naturaleza a su vez, los sólidos suelen clasificarse en elásticos o plásticos según si recuperan su forma original después de aplicarse una fuerza (Figura 2).

Figura 2
• Estado líquido: a diferencia de los sólidos, los líquidos no poseen una forma constante pero si un volumen fijo, lo que se debe al grado de cohesión entre las moléculas de los mismos, que es menor en comparación a los sólidos, de manera que al colocar un líquido en cualquier recipiente o superficie éste adopta la forma del mismo (Figura 3); pudiéndose distinguir dos propiedades como los son la fluidez y la viscosidad.
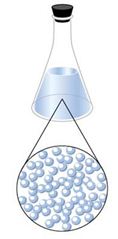
Figura 3. Estado líquido.
Tomado de: http://www.cambioplanetario.com/t4406-los-siete-estados-de-la-materia
La fluidez o viscosidad de un líquido se aprecia al comparar el paso de agua y el aceite por un canal, el agua al fluir rápidamente, sin dificultad es por tanto menos viscosa y el aceite al fluir o desplazarse lentamente, tiene mayor viscosidad (Figura 4)

Figura 4
• Estado gaseoso: los gases no poseen ni forma ni volumen definido, ya que sus moléculas se encuentran muy separadas entre sí, por lo que se desplazan libremente, disponiendo de toda la capacidad del lugar donde se encuentren, propiedad de los gases denominada como expansibilidad, como por ejemplo, el oxígeno molecular de la naturaleza, necesario para nuestra respiración aeróbica (Figura 5).
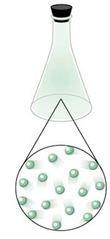
Figura 5. Estado gaseoso.
Tomado de: http://www.cambioplanetario.com/t4406-los-siete-estados-de-la-materia
Al igual que los líquidos, los gases, debido a su expansibilidad, poseen la capacidad de fluir, es decir, son fluidos, por lo que en ingeniería al estudio del movimiento o reposo de los materiales líquidos y gaseosos, se le conoce como mecánica de fluidos.
Existe otra propiedad de los gases conocida como compresibilidad, la cual se refiere al grado de compresión de los gases o disminución del espacio que ocupan al ejercer una presión, en donde al darse mucho la compresión del mismo se logra el paso al estado líquido; un ejemplo de ello lo vemos al calentar agua en un recipiente sin tapa, el agua al hervir se transforma en un gas, mientras que al ejercer una presión colocando una tapa al recipiente el vapor o gas de agua vuelve a su estado líquido, condensándose en la tapa en forma de gotas. Esta propiedad se ha aprovechado para transportar y almacenar con mayor facilidad a los gases en forma líquida, como por ejemplo en los recipientes conocidos como bombonas. (Figura 6)

Figura 6
El ejemplo del recipiente con agua hirviendo nos permite a su vez estudiar cómo la materia al ser sometida a cambios físicos se modifica de su estado original, en este caso, cambios de temperatura y presión. A continuación se explican los cambios de estado en la materia, en función al ejemplo con el solvente universal, el agua.
• La fusión y la solidificación: la fusión se refiere al paso del estado sólido a líquido, el cual se da al aplicar una temperatura, por ejemplo a un cubo de hielo; mientras que la solidificación es lo contrario, es decir, el paso del estado líquido a sólido que se da al enfriar o congelar el agua líquida . La fusión y la solidificación se dan a una temperatura propia de cada sustancia, conocida como punto de fusión, el cual en el agua es 0° C.
• La vaporización: se refiere al cambio de estado líquido a gaseoso, el cual se da al calentar un líquido a una temperatura específica en donde hierve, proceso conocido como ebullición, por lo que la temperatura de ebullición se llama punto de ebullición, siendo en el agua de 100° C. Cuando la ebullición se produce solo en la superficie de un líquido se le conoce como evaporación, proceso que no se da a una temperatura precisa.
• La condensación: se refiere al paso del estado gaseoso a líquido, por enfriamiento o compresión del gas. En química, se pueden estudiar sustancias que no siempre pasan por la transformación del estado sólido – líquido – gaseoso, como por ejemplo el yodo, el cual pasa de sólido a gas, proceso llamado sublimación; o de gas a sólido, proceso denominado condensación a sólido.

Por las características estudiadas se logran distinguir las sustancias unas de otras, sin embargo, una barra de metal no pasa por estos cambios de estados sino que presenta otros cambios o propiedades que la caracterizan, propiedades que el hombre ha aprovechado para diferentes fines, y que se estudian a continuación:
SENSORIALES
El color, el brillo, la textura, el olor y el tamaño son propios de cada material, encontrándose en la naturaleza materiales con diferentes tamaños y formas, grados de tonalidades, de luz u opacidad, de suavidad o rugosidad, entre otros.
FISICOQUÍMICOS
La incidencia de la luz en los materiales nos permite determinar su transparencia, es decir, si son transparentes, traslúcidos, opacos, como por ejemplo, un vaso de vidrio y un vaso de plástico.
Por otra parte, algunos materiales tienen la capacidad de verse afectados por el oxígeno y la humedad de la atmósfera, como en los metales, dándose el fenómeno conocido como corrosión, sin embargo, los materiales de plástico, vidrio, madera, entre otros, no se ven afectados por la oxidación. Otra forma de distinguir a los metales de los plásticos, vidrios o madera, es por su conductividad eléctrica, conductividad térmica, dilatación térmica y densidad.
Los metales poseen la capacidad de ser buenos conductores tanto de temperatura como de electricidad, calentándose uniformemente, dilatándose, es decir, aumentado de tamaño, además de permitir el paso de la corriente eléctrica a través de ellos; caso contrario en los demás materiales, los cuales se deforman al someterlos a altas temperaturas y actúan como aislantes eléctricos.
La densidad es una propiedad que describe la relación de la masa y el volumen de un material, por lo que, al hacer el experimento de un vaso con agua, y agregar un aro de metal y una esfera de un plástico, como el polietileno expandido, éste último flota, mientras que el aro se desplaza al fondo del vaso, ya que el metal es más denso que el agua y el plástico, y el plástico es menos denso que el metal y el agua.
MECÁNICAS
Como se indicó anteriormente, la dureza, tenacidad, fragilidad y elasticidad, son características propias de los materiales sólidos, así como su resistencia mecánica , indicando su capacidad para rayarse, romperse, estirarse o soportar fuerzas sin llegar a deformarse o romperse.
TECNOLÓGICOS
La ductilidad y maleabilidad son propiedades que determinan la capacidad de los materiales de transformarse en hilos y alambres o de deformarse sin fracturarse, respectivamente. Ambas propiedades en metales son muy estudiadas para el diseño de estructuras tan diferentes, como el papel aluminio, la carrocería de un automóvil o las instalaciones eléctricas de nuestras casas.
ECOLÓGICOS
Cada material posee en mayor o menor medida una toxicidad o daño al medio ambiente, así como una capacidad para degradarse en sustancias más simples, conocida como biodegradabilidad, o usarse para formar otros materiales, propiedad llamada reciclabilidad.
TIPOS DE FUERZAS QUE ACTÚAN SOBRE LOS MATERIALES (subtítulo)
La fuerza con la que se unen las moléculas, es decir, la fuerza molecular de un material, producto de la atracción o repulsión eléctrica entre las moléculas, actúa tanto entre materiales de diferente naturaleza como de un mismo tipo, observándose la fuerza de adhesión, la fuerza de cohesión y la tensión superficial
FUERZA DE ADHESIÓN
Ésta fuerza se observa cuando, después de ponerse en contacto dos materiales diferentes, éstos se atraen entre sí. Un ejemplo de esta fuerza se da cuando llueve y no utilizamos paraguas, nuestra vestimenta, piel y cabello se humedecen por atracción del agua con estos materiales.
FUERZA DE COHESIÓN
En la fuerza de cohesión la atracción mutua se da entre materiales de una misma naturaleza, como las moléculas que forman una hoja de papel o una barra de metal, siendo en esta última más fuerte la cohesión, ya que la barra de metal no se deforma tan fácilmente como la hoja de papel.
TENSIÓN SUPERFICIAL
Muchas veces se observa en algunos lagos o lagunas, que algunos insectos tiene la capacidad de desplazarse o bien, deslizarse sobre el agua, a pesar de que su densidad sea mayor al agua; esto se debe a la cohesión entre las moléculas de agua, lo que permite formar una tensión entre la superficie del sólido y la superficie del líquido; lo que da lugar a su vez a la capilaridad, la cual se refiere a la elevación o depresión del área de un líquido al entrar en contacto con un sólido.
Un ejemplo de capilaridad por fuerzas de adhesión y cohesión se observa al estudiar lo que ocurre al introducir una capilar de vidrio dentro de un vaso con agua, y a su vez, un tubo de mercurio. El capilar de vidrio produce una depresión o desplazamiento del agua por adhesión de las moléculas de agua a las paredes del tubo, formándose un menisco cóncavo de agua dentro del capilar; caso contrario sucede con el tubo de mercurio, en donde se da una elevación del nivel del agua al introducirlo, formándose un menisco convexo de agua dentro del tubo porque la cohesión de las moléculas de mercurio es mayor que la atracción de ellas y las paredes del tubo (Figura 7).
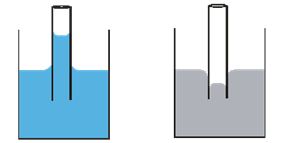
Figura 7. Capilaridad agua (izq.) y mercurio (der.)
Tomado de: http://fcm.ens.uabc.mx/~fisica/FISICA_II/APUNTES/CAPILARIDAD.htm
SUSTANCIAS PURAS Y MEZCLAS
Los materiales se clasifican a su vez de acuerdo a su pureza o si se encuentran formando parte de una mezcla. Las sustancias puras son aquellas de composición fija, pudiéndose descomponer por procesos químicos formando compuestos, o hallándose de forma elemental, denominándosele elementos. Las mezclas por su parte se dan de la unión física de dos sustancias sin que haya una reacción química entre ambas.
Los elementos podemos estudiarlos al tomar una tabla periódica, en donde se observa su clasificación en metales y no metales, siendo no metales aquellos con baja conductividad térmica, eléctrica, punto de fusión, de ebullición, y reflexión de luz.
MEZCLAS Y TÉCNICAS DE SEPARACIÓN
Las mezclas se clasifican en homogéneas y heterogéneas, según su composición y uniformidad.
En las mezclas heterogéneas, las sustancias a pesar de estar agrupadas a la vista pueden diferenciarse, pudiéndose observar como suspensiones en donde las partículas de una sustancia flotan delimitándose de la otra sustancia de la mezcla; por ejemplo, al mezclarse agua con tierra y pequeñas esferas de anime (polietileno expandido), se observan tres fases de arriba hacia abajo, las esferas de anime flotando, el agua, y la tierra sedimentada en el fondo por su mayor densidad.
En otros casos se puede observar coloides, por ejemplo, al mezclar arcilla fina con agua en donde las partículas al no ser, ni pequeñas como una solución o grandes como las suspensiones, la heterogeneidad no es tan clara pero la dispersión no es homogénea.
Debido a las características de las mezclas heterogéneas, estás pueden separarse por procesos mecánicos como la imantación, el tamizado, la sedimentación y la filtración.
• Imantación: este procedimiento mecánico es aplicable a mezclas de metales con materiales no metálicos a través de un imán, lográndose la separación por retención de los metales en el imán (Figura 8).
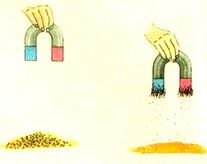
Figura 8. Imantación.
Tomado de: https://quimicaenaccion.wikispaces.com/B-+Propiedades+de+la+Materia
• Tamizado: su fundamento es el tamaño de las partículas involucradas en la mezcla, haciéndose pasar dicha mezcla por una o varias mallas con poros de diferentes tamaños, a lo que se le denomina tamiz. Según la diferencia del tamaño del poro quedarán retenidas y separadas las partículas unas de otras. (Figura 9)

Figura 9
• Sedimentación: está técnica puede estudiarse al agitar y luego dejar reposar una mezcla de un sólido no soluble en un determinado líquido en un recipiente, por ejemplo en la mezcla de arena y agua, en donde al pasar cierto tiempo la arena se sedimenta o reposa en el fondo del recipiente, formándose dos fases (Figura 10).

Figura 10. Sedimentación.
Tomado de: https://quimicaenaccion.wikispaces.com/B-+Propiedades+de+la+Materia
• Filtración: otra técnica para separar sólidos insolubles de un líquido es a través de una malla porosa, con poros mucho más pequeños que el tamiz, como por ejemplo, un colador de café, o un filtro de papel de laboratorio. (Figura 11)

Figura 11
En las mezclas homogéneas las sustancias agrupadas a la vista no pueden diferenciarse, dando una apariencia de uniformidad, por ejemplo al mezclar agua y sal, siendo en este caso el agua el solvente, el que está en mayor proporción, y la sal el soluto, el que está en menor proporción. Dado a la solubilidad del soluto en el solvente no es posible separar una vez mezcladas ambas sustancias por métodos mecánicos, utilizándose para éstas mezclas métodos físicos de separación, como la evaporación, la destilación, la cromatografía.
• Evaporación: la evaporación se realiza al calentar o aplicar una temperatura a la mezcla hasta que se evapore el líquido quedando en el fondo del recipiente el sólido (Figura 12). No se debe confundir ésta técnica con la evaporación natural de algunos materiales sin que influya la temperatura, como por ejemplo en alcoholes al contacto con el aire, propiedad conocida como volatilidad.
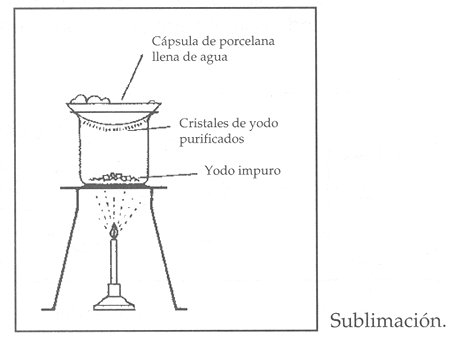
Figura 12
• Destilación: en la destilación la separación se da al calentar la mezcla hasta que el componente más volátil pasa a través de un condensador por el que fluye agua a temperatura ambiente, por lo que dichos componentes pasan de nuevo al estado líquido y logran separase de la mezcla. (Figura 13)
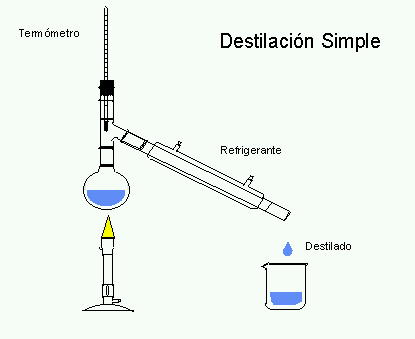
Figura 13
• Cromatografía: esta técnica se basa en las diferencias en los grados de absorción de los componentes de la mezcla frente a un material inerte con el que no reaccionan, como un papel de filtro, por lo que según su capacidad específica, estos se absorberán compitiendo por los sitios libres del material, separándose una sustancia de otra (Figura 14). Esta técnica se denomina cromatografía en papel y es la cromatografía más básica, conociéndose también otros tipos como, la cromatografía en columna, en capa fina, cromatografía líquida de alta presión (HPLC), cromatografía de gas, entre otras.
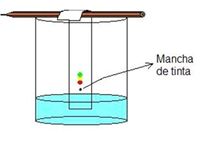
Figura 14. Cromatografía en papel.
Tomado de: http://proyectosenquimica.blogspot.com/2010/10/cromatografia-de-papel.html
Referencias bibliográficas:
Coella, O; Ojeda, F. (2008). Tecnología, Profesorado. La Aldea de San Nicolás. Consulta en línea: http://www.ieslaaldea.com/index.php?option=com_content&task=section&id=17&Itemid=60
Martín, J. (1994). Estudios de la naturaleza. Primer año de Educación Media. (1a. ed.) Revisada 2011. Caracas, Venezuela. Pág: 17-29.