 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
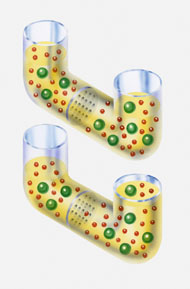
Existe muchos procesos químicos y biológicos que dependen de la ósmosis: paso selectivo de solvente, no de soluto, por una membrana porosa desde una solución diluida a otra más concentrada. La presión necesaria para evitar que esto suceda se llama presión osmótica de la solución y obedece una ley similar a la ley del gas ideal.
Presión osmótica
Cuando se experimenta con soluciones diluidas, las moléculas de soluto tienden a moverse en todas las direcciones y tratan de ocupar todo el volumen posible, en semejanza al comportamiento de los gases; por lo que, al igual que ellos, las moléculas de soluto ejercen una presión, que se denomina presión osmótica.
Esta presión es posible estudiarla cuando se coloca una solución a difundir por medio de una membrana semipermeable que permite el paso del solvente (agua), pero no de las moléculas de soluto disueltas. Las moléculas de agua pasan a través de la membrana en ambas direcciones, pero, como la concentración de estas moléculas de agua es mayor en el solvente que en la solución, hay un flujo neto desde el solvente hacia la solución, movimiento conocido como ósmosis. Así, el solvente (en azul) diluye a la solución (en verde), la cual asciende por el tubo. La presión osmótica (π) se puede determinar a partir de la diferencia entre los niveles finales del líquido.
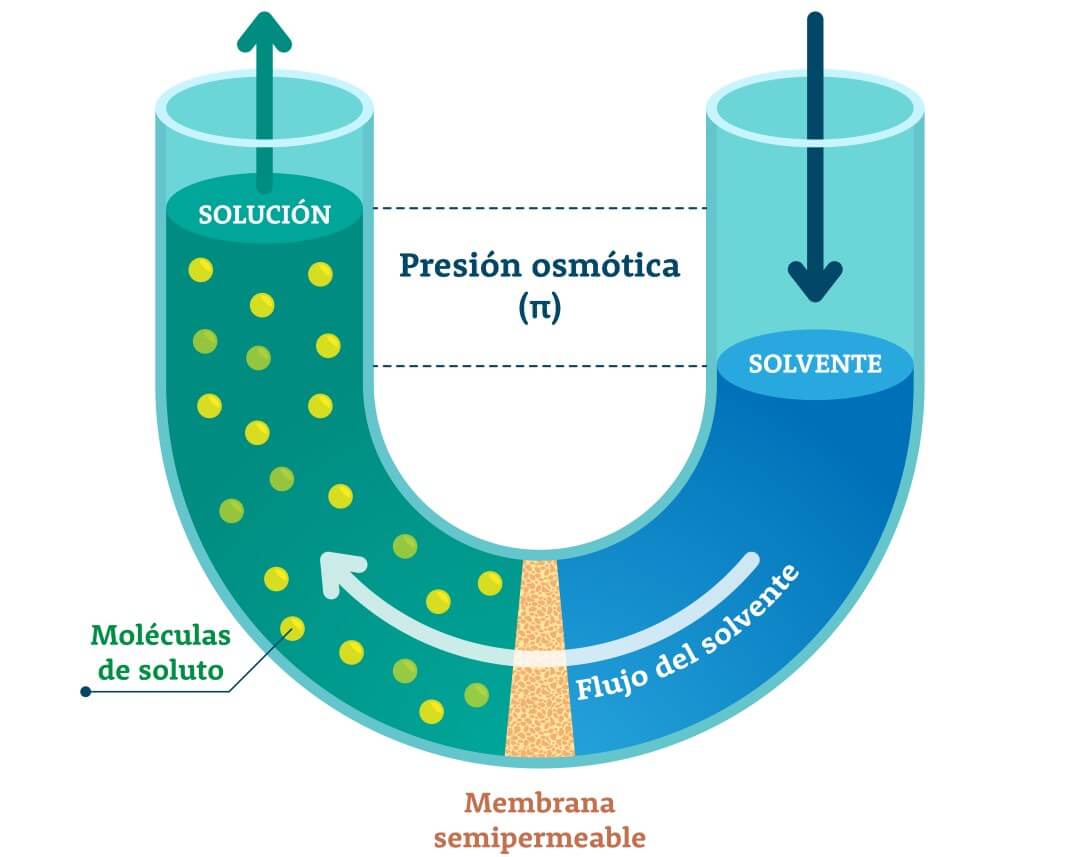
Figura 1: Presión osmótica.
La presión osmótica (π) de una solución puede definirse como el exceso de presión que debe aplicarse a la solución que está separada a través de una membrana semipermeable del solvente puro e impedir la ósmosis del solvente hacia la solución. Entonces, la presión osmótica es una propiedad coligativa directamente proporcional a la concentración de soluto y a las temperaturas absolutas.
De acuerdo con el comportamiento de soluciones muy diluidas, no electrolíticas, y su analogía con los gases, la presión osmótica (π) de una solución está dada por:
donde π es la presión osmótica en atmósferas (atm), n es la cantidad de soluto en moles, R es la constante universal de los gases (0,0821 L · atm/ K · mol), T es la temperatura en Kelvin (K) y V es el volumen de la solución en litros (L).
Estudiemos ahora las diferentes situaciones problemáticas que puedan presentarse al calcular la presión osmótica de las soluciones.
1. ¿Cuál es la presión osmótica de una solución cuando se disuelven 500 gramos glucosa (C6H12O6) en 2.000 mililitros de agua a 28 °C?
Paso 1: escribir los datos.
Gramos de soluto: 500 g de C6H12O6
Volumen de solución: 2.000 mL
Temperatura: 28 °C
Presión osmótica (π): ?
Paso 2: calcular el número de moles de soluto. Para esto es necesario saber la masa molecular del compuesto.
Inicialmente, identificaremos los valores de masa atómica del carbono (C), oxígeno (O) e hidrógeno (H); son los siguientes:
C = 12 g/mol O = 16 g/mol H = 1 g/mol
Con esos datos se calculará la masa molecular de C6H12O6. Es importante tomar en cuenta el número de átomos de cada elemento para realizar el cálculo.
C = 6×12 = 72 g/mol O = 6×16 = 96 g/mol H = 12×1 = 12 g/mol
Masa molecular de C6H12O6 = (72 + 96 + 12) g/mol = 180 g/mol
Ahora hallamos el número de moles (n):
También podemos usar la siguiente fórmula:
Paso 3: calcular el volumen de la solución en litros. Para esto hacemos la siguiente conversión:
Paso 4: calcular la temperatura en Kelvin.
Paso 5: calcular la presión osmótica (π) a partir de la fórmula propuesta anteriormente.
2. ¿Qué cantidad de soluto en gramos está contenido en 200 mililitros de solución de glucosa, con una presión osmótica de 2 atmósferas a 0 °C?
Paso 1: escribir los datos.
Gramos de soluto: ?
Volumen de solución: 200 mL
Temperatura: 0 °C
Presión osmótica (π): 2 atm
Paso 2: calcular el volumen de la solución en litros.
Paso 3: calcular la temperatura en Kelvin.
Paso 4: calcular el número de moles de soluto a partir de la fórmula de presión osmótica. Para esto debemos despejar.
Paso 5: calcular los gramos de soluto a partir de los moles de solutos y el valor de su masa molecular (C6H12O6 = 180 g/mol)..