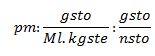VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS

Dentro de las propiedades coligativas de las soluciones se puede estudiar el punto de congelación o el descenso del punto de congelación de la solución. Recordemos que el punto de ebullición, es la temperatura a la cual la fase líquida y sólida, tienen igual presión de vapor.

Punto de congelación
El punto de congelación de una solución disminuye cuando posee mayor cantidad de solutos no volátiles disueltos. Si a una muestra de agua de determinado volumen, se le agrega una cantidad de soluto, esta ya no se congelará a 0 °C sino a una temperatura menor.
El descenso del punto de congelación se debe directamente al descenso de la presión de vapor de una solución, por lo que al agregar cualquier cantidad de soluto no volátil a la solución disminuye la presión de vapor y las soluciones se congelan a temperaturas menores.
La crioscopía es la rama de la química que se encarga del estudio del descenso del punto de congelación de un solvente puro como consecuencia de un soluto. Se denomina entonces descenso crioscópico a la diferencia entre los puntos de congelación de un solvente y de una solución a una presión constante determinada, la cual depende directamente de la concentración del soluto y no de su naturaleza pero sí de la naturaleza del solvente empleado.
Al estudiar la figura 1, la cual compara las presiones de vapor de una solución y de un solvente puro a diferentes temperaturas, notamos diferentes fenómenos:

Figura 1. Elevación del punto de ebullición y descenso del punto de congelación de una solución. Tomado de: http://propicolquimica.galeon.com/disminucion_co.html
Según las leyes de Raoult, la disminución del punto de congelación es directamente proporcional al número de moles de la sustancia disuelta:
ΔTc = To - Tc = Kc Ml
, donde ΔTc es el descenso o variación del punto de congelación de la solución, Tc es el punto de congelación de la solución, To es el punto de congelación del solvente puro, Kc es la constante crioscópica molal de un solvente dado, y Ml la molalidad de la solución. En la tabla 1, se muestran algunas constantes crioscópicas molales para diferentes tipos de solventes, indicando que, por ejemplo, para el caso del fenol, un mol de soluto no volátil y no electrolítico disuelto en 1 kg de acetona genera una disminución del punto de congelación de 7,27 °C, es decir, que la solución no congelará a 42 °C sino a 34, 73 °C.

Tabla 1. Comparación del punto de congelación y sus constantes crioscópicas de solventes dados.
Estudiemos ahora las diferentes situaciones problemáticas que puedan presentarse al calcular el punto de congelación de una solución dada y su descenso.
1. ¿Cuál es el punto de congelación de una solución y su descenso cuando se disuelven 5 gramos de azúcar (glucosa, C6 H12 O6) en 1500 gramos de agua?
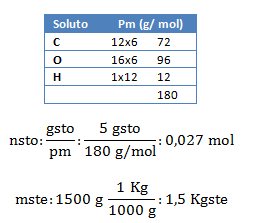
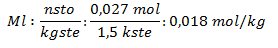

2. ¿Cuál es el peso molecular de 1,12 gramos de una sustancia que ha sido disuelta en 180 gramos de agua congelada a – 0,118 °C?