 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Los átomos se unen mediante sus electrones más externos, con la finalidad de alcanzar una situación de mayor estabilidad como la de los gases nobles, cuya última capa está completa con ocho electrones. Según como se produzca la unión entre los átomos, se pueden encontrar tres tipos de enlaces, que se describen a continuación.
1. Enlace iónico: el término enlace iónico se refiere a las fuerzas electrostáticas que existen entre iones con cargas opuestas. Estos iones se forman por la transferencia de uno o más electrones de un átomo a otro. Estas sustancias iónicas generalmente se forman de las interacciones entre un metal y un no metal, formándose así una sustancia iónica, por ejemplo, el cloruro de sodio o sal de mesa.

Sal.
2. Enlace covalente: un enlace covalente es el resultado de que dos átomos compartan electrones entre sí. Generalmente los enlaces covalentes se forman por la interacción entre dos elementos no metálicos, por ejemplo, la molécula de oxígeno.
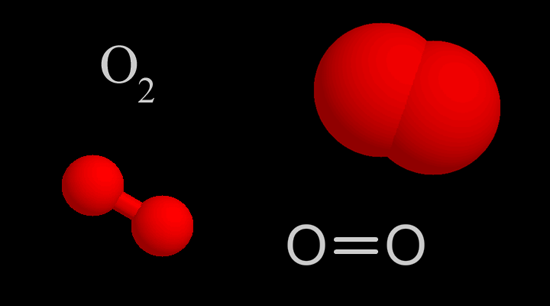
Unión covalente entre átomos de oxígeno.
3. Enlace metálico: los enlaces metálicos se forman en metales como el cobre, hierro y aluminio. En estos tipos de enlaces los electrones se mueven fácilmente dentro de la red tridimensional del metal dando lugar a una de las principales características de los metales como lo es una alta conductividad eléctrica.

Texturas metálicas: aluminio, bronce, latón.