 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
La constante de equilibrio o ley de equilibrio químico está determinada por el cociente entre las dos constantes de velocidad en función a la temperatura.
Se define como la fracción donde el numerador está representado por el producto entre las concentraciones (mol/L) de los compuestos de la reacción directa (lado derecho) y el denominador se representa por el producto entre las concentraciones (mol/L) de los compuestos de la reacción inversa (lado izquierdo). Véase fórmula de Kc.
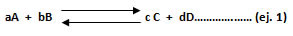
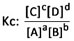
Los coeficientes estequiométricos de cada sustancia, una vez que la reacción esté balanceada, se escribirán en forma de potencia para cada concentración.
Se estudiarán ahora las diferentes situaciones problemáticas que puedan presentarse al calcular el valor de la constante de equilibrio (Kc) o la concentración en equilibrio de algún compuesto.
1. Calcular la constante Kc para la reacción en equilibrio entre nitrógeno molecular a 0,5 M e hidrógeno molecular a 1,3 M para formar amoniaco a 0,07 M. La temperatura en el sistema es de 8000 K.
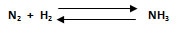
[N2]: 0,5 mol/L ; [H2]: 1, 3 mol/L ; [NH3]: 0,07 mol/L ; T: 8000 K; Kc: ¿?

2. Calcular la constante Kc para la reacción en equilibrio entre un mol de agua y 0,9 moles de monóxido de carbono, para formar 0, 3 moles de hidrógenos molecular y un mol de dióxido de carbono. La temperatura en el sistema es de 986 °C, en un recipiente de 10 L.
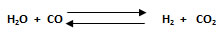
nH2O: 1 mol ; nCO: 0,9 mol ; nH2: 0,3 mol ; nCO2: 1 mol; T: 986 °C; V: 10L; Kc: ¿?


3. Calcular el número de moles de cloruro de fósforo (V) que habrá en un recipiente de 3 L, para la reacción en equilibrio que contiene 1,1 moles de cloruro de fósforo (III) y 1 mol de cloro molecular. La constante Kc: 3.
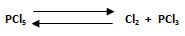
V: 3 L ; nPCl3: 1,1 moles ; nCl2: 1 mol ; Kc: 3 ; nPCl5: ¿?
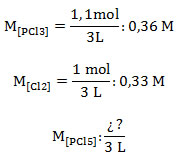

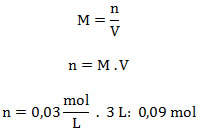
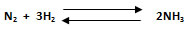
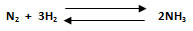
4. Calcular la constante Kc para la reacción en equilibrio entre nitrógeno molecular e hidrógeno molecular para formar amoniaco, en un recipiente de 3 L a 500 °C. La presión en el sistema es de 330 atm, siendo las presiones parciales de los gases: N2: 46 atm, H2: 100 atm y NH3: 110 atm.


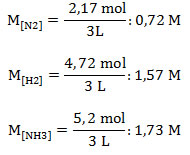
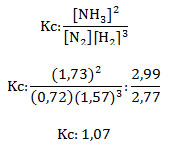
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 425-429.