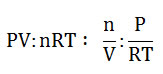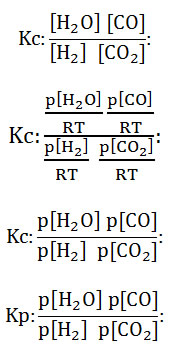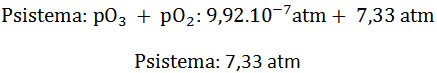Constante del equilibrio químico en función a las presiones parciales. Ejercicios. Parte II
Se estudiarán las diferentes situaciones problemáticas que puedan presentarse al calcular el valor de la constante del equilibrio en función a las presiones parciales. Para estos casos, la constante Kc pasa a llamarse Kp.
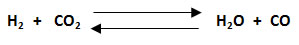
5. Calcular la constante Kc y Kp para la reacción en equilibrio entre hidrógeno y dióxido de carbono, para formar agua y monóxido de carbono. La temperatura en el sistema es de 986 °C, en un recipiente de 10 L, siendo las presiones parciales de los gases: H2: 26 atm, CO2: 60 atm, H2O: 30 atm y CO: 80 atm.
- El primer paso es escribir los datos:

- La ecuación está balanceada. Al estudiarse la fórmula PV: n R T, se obtiene el razonamiento de que n/V, la concentración de un gas en mol por litro a temperatura constante, es directamente proporcional a su presión parcial, es decir:
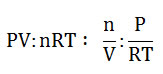
- Sustituyendo los términos, la ecuación queda:
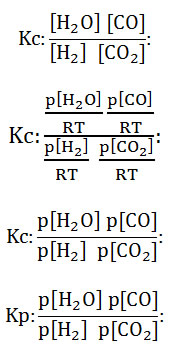
- Para las reacciones en equilibrios gaseosos, en donde no haya cambios en el número total de moles, es decir, donde haya igual número de moles de reactivos y de productos, se dice entonces que la constante Kc es igual al Kp. Se sustituyen los datos en la fórmula para calcular la constante de equilibrio:

6. Calcular la presión parcial del ozono y la presión total del sistema, para la reacción en equilibrio con oxígeno molecular en un recipiente de 8 L a 1727 °C. La presión parcial del oxígeno molecular es 7,33 atm y la Kp: 4.1014.
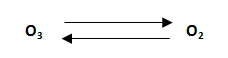
- El primer paso es escribir los datos:
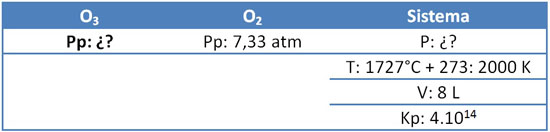
- Se balancea la ecuación.

- Para calcular la presión parcial del ozono, se realiza el despeje de la ley del equilibrio químico:

- Para calcular la presión total del sistema se realiza la sumatoria de las presiones parciales, por lo que:
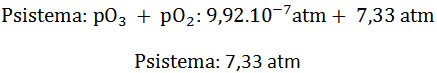
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 430-434.
 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS