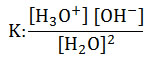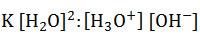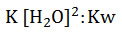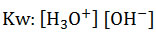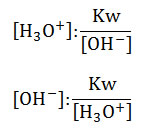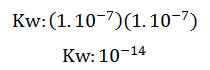La constante de ionización del agua
El agua es una molécula que se comporta como ácido y como base, en función al compuesto con el cual reacciona. Por dicho comportamiento es llamada una molécula anfótera.
A su vez, el agua pura es un electrolito débil que se autoioniza (autoprotólisis) escasamente, disociándose en iones hidronio y oxhidrilo de la siguiente forma:

- La reacción de disociación en equilibrio químico ha demostrado experimentalmente que éste se encuentra más desplazado hacia la izquierda, es decir, que en agua pura el porcentaje de iones hidronio y oxhidrilo es bastante bajo, prevaleciendo las moléculas de agua.
- La ley del equilibrio químico para el agua pura es:
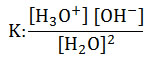
- Al ser constante la cantidad de moléculas de agua en la reacción de disociación, ésta se convierte en otra constante, la cual puede pasar al numerador del primer miembro:
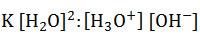
- El producto entre dos constantes es otra constante, que se denominará Kw (del inglés water: agua), por lo que:
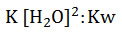
- Como Kw representa el producto de iones, la constante es llamada constante de producto iónico del agua:
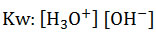
- De la constante del producto iónico del agua, se pueden calcular las concentraciones de los iones hidronio y oxhidrilo, realizando los despejes:
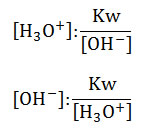
- El agua pura a 25 °C, posee una misma concentración de iones hidronio e iones oxhidrilo de 1.10-7 mol/L, ya que por cada molécula de agua que se disocia se forma un ión hidronio y un ión oxhidrilo. Al sustituir las concentraciones en la fórmula, queda:
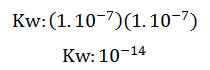
- La igualdad en las concentraciones de los iones hidronio y oxhidrilo se debe a la neutralidad del agua pura, por lo que si, por ejemplo, la concentración de iones hidronio es mayor a 1.10-7 mol/L, por ende la de iones oxhidrilo es menor, siendo ahora el agua o solución estudiada, ácida; en el caso contrario, que la concentración de iones oxhidrilo sea mayor a 1.10-7 mol/L, y por consiguiente la iones hidronio menor, la solución acuosa es básica.
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 447-448.
 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS