 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS

Cuando los sistemas en equilibrio químico son perturbados por un efecto externo, el equilibrio se desplaza en uno de los dos sentidos hasta lograr nuevamente el estado de equilibrio. Los factores que afectan el equilibrio en los sistemas reversibles son la variación en la concentración, la variación en la presión, la variación en la temperatura y los catalizadores.

EFECTO DE VARIACIONES EN LA CONCENTRACIÓN

Al aumentar la concentración de unas de las sustancias implicadas en la reacción reversible, el equilibrio se rompe y será desplazado hacia la reacción directa o inversa, hasta que se consuma el exceso de la sustancia y se restablezca el equilibrio. Veamos el efecto de la concentración a través de un ejemplo:
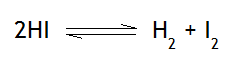
Ejemplo 1
En el ejemplo 1, supongamos que se aumenta la concentración del ácido yodhídrico (HI) al agregar mayor cantidad de dicho compuesto. Una vez que variemos la concentración del reactivo, el equilibrio se rompe, y aumenta la reacción directa, es decir, la reacción de formación del hidrógeno molecular (H2) y yodo molecular (I2), quedándonos:
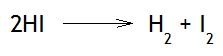
Ejemplo 2
El desequilibrio se debe a que aumentará la velocidad de la reacción correspondiente a la formación de los productos, y al no ser iguales las velocidades de las reacciones directa e inversa, el sistema se desplaza hacia la derecha, hasta que las velocidades se igualen nuevamente.
Posteriormente, el equilibrio se desplazará rápidamente en el sentido de consumir el exceso de sustancia adicionada, por lo que una vez que se consume el exceso de HI que se adicionó, se regenera el equilibrio del sistema (ej. 1).
EFECTO DE VARIACIONES EN LA PRESIÓN


Al aumentar la presión en un sistema químico, el equilibrio se rompe y será desplazado hacia donde exista menor número de moles para restablecer el equilibrio. Veamos el efecto de la presión a través de un ejemplo:
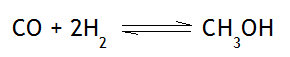
Ejemplo 3
En el ejemplo 3, observamos que existe 1 mol de monóxido de carbono y 2 moles de hidrógeno molecular, resultando 3 moles de reactivos, mientras que en los productos solo hay un mol de metanol. Al aumentar la presión del sistema en equilibrio químico, el equilibrio se fracciona, y aumenta la reacción directa, es decir, la reacción de formación del metanol, quedándonos:
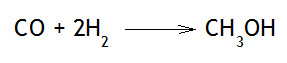
Ejemplo 4
El aumento de la presión hace que los moles de los reactivos ocupen un menor volumen que el del estado inicial, lo que hace que aumente a su vez su concentración. El exceso de moléculas de reactivos, las cuales se combinan para formar más producto, hacen que el equilibrio se desplace hacia donde haya menor volumen, es decir, hacia la formación de metanol.
En caso de que se disminuya la presión del sistema, el equilibrio se desplaza hacia donde haya mayor volumen, en este mismo ejemplo, hacia la formación de los reactivos.
Referencias bibliográficas:
Suarez, F (2011). Química teoría. 4to año de Educación media general. Editorial Romor. Caracas, Venezuela. Pág: 63-64