 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Al estudiar la estequiometría de las sustancias y reacciones químicas, es necesario estar claros sobre los términos y definiciones referentes a la masa de las sustancias.
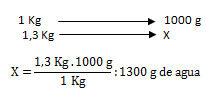
La masa es aquella propiedad extensiva de la materia que indica la cantidad de materia que tiene un cuerpo y posee un volumen. Se puede medir con una balanza y, según el Sistema Internacional de Medidas (SI), su unidad base a nivel macroscópico es el kilogramo (Kg), el cual equivale a 1.000 gramos. Un ejemplo de la conversión de unidades sería expresar 1,3 Kg de agua (H2O) en gramos; aplicando una regla de tres, queda:
Por otra parte, se conoce que en los cálculos estequiométricos se utilizan otras unidades para determinar la masa de las sustancias, como el mol, la masa atómica relativa, la masa molecular relativa y la masa molar. A continuación, se estudiarán los diferentes términos antes mencionados con su ejercitación.
EL MOL (n)
Es la unidad que mide la cantidad de sustancia de un elemento o compuesto a nivel microscópico, es decir, a nivel de átomos, iones, electrones, protones, moléculas o partículas. El mol surgió como parte del problema cuantitativo que presentaban los científicos al contar o pesar partículas tan pequeñas como un átomo o una molécula.
La unidad mol fue definida bajo diferentes métodos, entre ellos la difracción de rayos X, utilizando 12 gramos del isótopo doce del carbono (12C), el cual equivale a 6,02.1023 formas microscópicas (átomos, iones, electrones, protones, moléculas o partículas). Este valor es llamado constante o número de Avogadro, en honor al físico y químico Lorenzo Amadeo Avogadro.
La constante de Avogadro se representa con la letra L o NA, y se expresa matemáticamente de la siguiente manera:
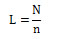
Donde N es el número de partículas, y n, la cantidad de sustancia en mol o el número de moles. Un ejemplo de dicho cálculo sería determinar la cantidad de moles de agua de una muestra de 4. 1024 moléculas, el cual queda:
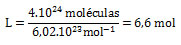
Ahora bien, es necesario que los estudiantes comprendan la importancia de entender el uso de la unidad mol. Anteriormente eran muy utilizados los términos peso atómico y peso molecular, es decir, que la sumatoria de los pesos atómicos de cada elemento de una molécula nos da su peso molecular.
Continuando con el ejemplo del agua (H2O), cuyo peso molecular es 18 g (Revisar en tabla periódica: H = 1 g/mol; O = 16 g/mol), puede concluirse entonces que cada molécula de agua pesa 18 g. ¿Dónde está el error de la suposición? Si por cada gota de agua hay millones de moléculas cuyo peso es 18 g, ¿imaginas la cantidad de gramos de agua que ingieres al beber un vaso con agua? La interpretación correcta de dicho peso molecular sería que el conjunto de moléculas de agua, cuya cantidad es 6,02.1023 es la que pesa 18 g.
En conclusión, el mol representa la cantidad de sustancia que posee un número fijo de partículas numéricamente igual a 6,02.1023.
MASA ATÓMICA RELATIVA PROMEDIO O MASA ATÓMICA Ar (E)
Como anteriormente se indicó, el isótopo doce del carbono (12C) es el utilizado para definir la unidad mol. Esto se debe a que el carbono 12 es el isótopo más abundante y por ello se usa como átomo patrón para determinar la masa atómica relativa promedio o masa atómica de los elementos de la tabla periódica. El término relativo viene dado por los valores tan pequeños de las masas de los átomos y moléculas.
Para determinar la masa atómica de un elemento se compara cuántas veces un elemento es más pesado que el isótopo doce del carbono.
La masa atómica del carbono es exactamente 12uma (u) ó 12Dalton (Da), siendo ambas unidades válidas para definir la masa atómica de un elemento. La unidad Dalton es denominada en honor al químico John Dalton.
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 40 - 42.
Suarez, F (2011). Química teoría. 4to año de Educación media general. Editorial Romor. Caracas, Venezuela. Pág: 28- 29.