 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
La fracción molar, también llamada fracción de mol, es una magnitud que expresa el número de moles de soluto por cada mol de partículas de la solución. La fracción molar es una magnitud sin unidades ya que se halla al dividir el número de moles de soluto de una solución determinada entre el número total de moles de dicha solución. La fórmula para realizar el cálculo de la fracción molar (X) es:

, donde nsto, son los moles de soluto, Xsto fracción molar de soluto, nsol número de moles de solución, Xste fracción molar de solvente, nste número de moles de solvente. La sumatoria de las fracciones molares de soluto y las fracciones molares del solvente serán siempre igual a 1. Al ejecutar el cálculo, los moles se cancelan debido a la división y por ello la fracción molar no tiene unidades.
Estudiemos ahora las diferentes situaciones problemáticas que puedan presentarse al calcular la fracción de mol de una solución dada.
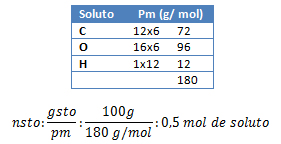
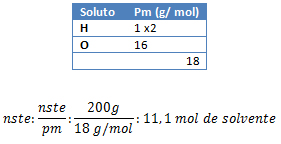
1. Calcule la fracción de mol de una solución que posee 100 gramos de azúcar (C6H12O6), disueltos en 200 gramos de agua.
gsto: 100 g C6H12O6 ; gste: 200 g H2O; Xsol: ¿?
pm C6H12O6: ¿?
pmH2O: ¿?
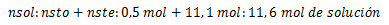

Autoevaluación.
1. Determinar la fracción de mol de una solución que contiene 20 gramos de NaCl disueltos en 86 gramos de agua.
2. Determinar la fracción de mol de soluto y de solvente de una solución de 100 gramos que contiene los 10 gramos de soluto (KClO4) disueltos en agua destilada.
3. Determinar la fracción de mol de soluto y de solvente de una solución de 946 gramos de agua salada, que contiene 50 gramos de NaCl.
Referencias bibliográficas:
Suarez, F (2011). Química teoría. 4to año de Educación media general. Editorial Romor. Caracas, Venezuela. Pág: 44 -45.