 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
HIDRUROS METÁLICOS
Los hidruros metálicos son combinaciones binarias que se forman de la unión de un metal con el hidrógeno. Para hidruros metálicos, el hidrógeno se comporta como si fuese el no metal, es decir, como la parte más electronegativa, escribiendo su símbolo a la derecha y el del metal hacia la izquierda.

Según el sistema Stock, los hidruros metálicos se nombran de igual manera que las reglas ya descritas, utilizando la palabra hidruro en continuación a la preposición de, luego el nombre del metal, y por último se escribe en números romanos y entre paréntesis su número de oxidación.
Hidruro de + nombre del no metal (número de oxidación)
Estudiemos un ejemplo:
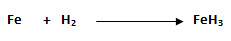
Según la nomenclatura estequiométrica o nomenclatura de proporciones, los compuestos se nombran en función al número de átomos de cada elemento. Se utiliza la siguiente fórmula:
Prefijo + hidruro de + metal
Estudiemos los siguientes ejemplos con el metal plomo:
a) PbH4: esta fórmula corresponde al tetrahidruro de plomo, el prefijo tetra viene dado por los cuatro átomos de hidrógeno, seguido del nombre del metal.
b) PbH2: esta fórmula corresponde al dihidruro de plomo, el prefijo di viene dado por los dos átomos de hidrógeno, seguido del nombre del metal.
La I.U.P.A.C recomienda el uso de la nomenclatura Stock y estequiométrica, sin embargo es necesario conocer la nomenclatura antigua o tradicional, siguiendo la fórmula:

Estudiemos los siguientes ejemplos:
a) Con el hierro (Fe): FeH2, FeH3
b) Con el plomo (Pb): PbH2 , PbH4
Las tres nomenclaturas descritas pueden compararse al estudiar la siguiente tabla con los elementos, sodio, bario, cobalto, estaño y cobre.
Tabla 1. Comparación de nomenclaturas utilizadas para algunos hidruros metálicos.

HIDRUROS NO METÁLICOS
Los hidruros metálicos son combinaciones binarias de la unión de hidrógeno y un no metal de menor electronegatividad. Para hidruros no metálicos, el hidrógeno continúa comportándose como si fuese el no metal, como la parte más electronegativa, escribiéndose su símbolo a la derecha y el del no metal de menor electronegatividad hacia la izquierda.
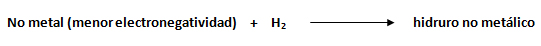
Para la nomenclatura de hidruros no metálicos suelen emplearse nombres sistemáticos y comunes, tales como en los ejemplos a continuación, con los elementos, fósforo, nitrógeno, silicio y arsénico:
a) Con fósforo (P): PH3, P2H4
b) Con nitrógeno (N): NH3, N2H4
c) Con silicio (Si): SiH4
d) Con arsénico (As): AsH3
ÁCIDO HIDRÁCIDO
Los ácidos hidrácidos son combinaciones binarias formadas por hidrógeno y elementos no metálicos de mayor electronegatividad. Para los ácidos hidrácidos, el hidrógeno se comporta como el metal, es decir, como la parte menos electronegativa, escribiendo su símbolo a la izquierda y el del no metal de mayor electronegatividad hacia la derecha.
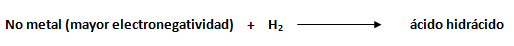
Los ácidos hidrácidos reciben su nombre dado a su capacidad de disolverse en agua y formar compuesto ácidos, entre ellos los elementos: flúor (F), cloro (Cl), bromo (Br), yodo (I), azufre (S), selenio (Se) y teluro (Te).
Para la nomenclatura de estos compuestos, al igual que en el caso de hidruros no metálicos, suelen utilizarse la nomenclatura estequiométrica o sistemática, siempre que el elemento no metálico no esté disuelto en agua, escribiendo la terminación uro luego de la raíz del nombre del no metal, en continuación la preposición de, luego de la palabra hidrógeno.
Raíz del nombre del no metal + uro de hidrógeno
Estudiemos un ejemplo:

Si el elemento no metálico se encuentra disuelto en agua o lo que es igual decir, en solución acuosa, la nomenclatura comenzará con la palabra ácido, seguida de la raíz del nombre del no metal más el sufijo hídrico. Se utiliza la siguiente fórmula:
Ácido + raíz del nombre del no metal + hídrico
Estudiemos un ejemplo:

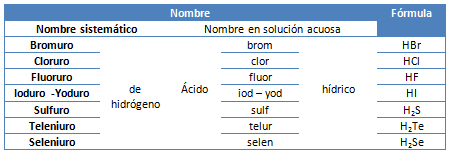
A continuación en la tabla 2, se comparan las nomenclaturas descritas para ácidos hidrácidos de los elementos no metálicos altamente electronegativos:
Tabla 2. Comparación de nomenclaturas utilizadas para ácidos hidrácidos.
Referencias bibliográficas:
Cuerpo de redacción (1997). Mentor interactivo. Enciclopedia temática estudiantil. Editorial Océano. Barcelona, España. Pág: 410.
Suarez, F (2011). Química teoría. 4to año de Educación media general. Editorial Romor. Caracas, Venezuela. Pág: 14 - 15.