 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Dentro de la variedad de formas de expresar la concentración de las soluciones, existe una magnitud que expresa la cantidad de sustancia disuelta en un solvente expresado en kilogramos, denominada molalidad.
MOLALIDAD
La molalidad es una magnitud que expresa el número de moles de soluto por kilogramo de solvente, por lo que si se dice que una solución posee una concentración molal o molalidad de 0,5 mol/kgste, se refiere a que por cada kilogramo de solvente están disueltos 0,5 mol de soluto. La fórmula para realizar el cálculo del la molalidad (Ml) es:
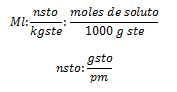
, donde nsto, son los moles de soluto, kgste, los kilogramos de solvente, gsto, los gramos de soluto, y pm, el peso molecular del soluto.
Estudiemos ahora las diferentes situaciones problemáticas que puedan presentarse al calcular la concentración molal o molalidad de una solución dada.
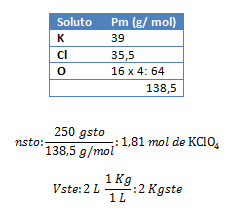
1. Calcule la concentración en mol/Kgste de una solución que ha sido preparada disolviendo 250 g de perclorato de potasio (KClO4) en 2 L de agua destilada.
Vste: 2 L de agua destilada; gsto: 250 g ; Ml: ¿?
pmKClO4: ¿?
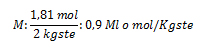
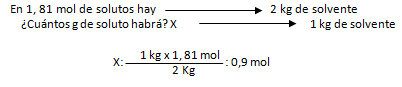
2. Calcule la masa de solvente de agua destilada que se necesita para disolver 200 gramos de azúcar (C6H12O6), de una solución al 0,3 molal.
Ml: 0,3 mol/kgste de solución azucarada; gsto: 200 g; Kste: ¿?
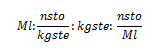
pm C6H12O6: ¿?

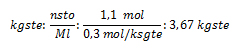
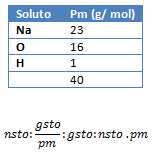
3. Calcule la cantidad de gramos hidróxido de sodio (NaOH) que se disuelven en 600 cm3 de agua destilada, en una solución al 0,8 mol/kgste.
kgste: 600 cm3; Ml: 0,8 m/kgste ; gsto: ¿?
pmNaOH: ¿?
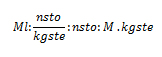
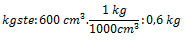
Sustituyendo nos queda:
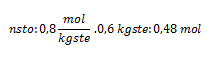
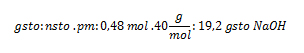
Autoevaluación.
1. Determinar la concentración m/kgste de una solución de 300 mL, preparada con 20 g de NaOH.
2. Determine los gramos de solución de 1,5 Ml, disueltos en 3 L de agua destilada.
3. Calcule el volumen de solvente de una solución de concentración 1 Ml, preparada con 10 g de CuSO4.
Referencias bibliográficas:
Cuerpo de redacción (1997). Mentor interactivo. Enciclopedia temática estudiantil. Editorial Océano. Barcelona, España. Pág: 37-40.
Suarez, F (2011). Química teoría. 4to año de Educación media general. Editorial Romor. Caracas, Venezuela. Pág: 41.