 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Existen muchas formas de expresar la concentración de las soluciones, siendo una de las más importantes y utilizada la magnitud, que relaciona la cantidad de sustancia o soluto expresado en moles o número de moles (nsto, n), con el volumen de la solución expresado en litros, denominada molaridad.
MOLARIDAD
La molaridad es una magnitud que expresa el número de moles de soluto por litro de solución, por lo que si se dice que una solución posee una concentración de 0,5 mol/l, se refiere a que por cada litro de solución hay 0,5 mol de soluto. La fórmula para realizar el cálculo del la molaridad es:
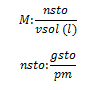
, donde nsto, son los moles de soluto, vsol, los litros de la solución, gsto, los gramos de soluto, y pm, el peso molecular del soluto.
Estudiemos ahora las diferentes situaciones problemáticas que puedan presentarse al calcular la concentración molar o molaridad de una solución dada.
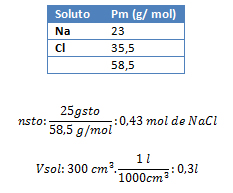
1. Calcule la concentración en mol/l de 300 cm3 de una solución que ha sido preparada disolviendo 25 g de sal común (NaCl) en agua destilada.
Vsol: 300 cm3 de agua salada; gsto: 25 g; M: ¿?
pmNaCl: ¿?
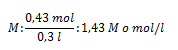
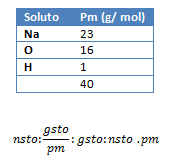
2. Calcule la cantidad de gramos hidróxido de sodio (NaOH) que se necesitan para preparar una solución de concentración en 0,8 mol/l en 500 cm3 de una solución.
Vsol: 500 cm3 de solución; M: 0,8 m/l; gsto: ¿?
pmNaOH: ¿?
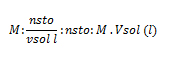
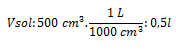
Sustituyendo nos queda:
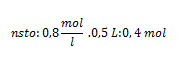
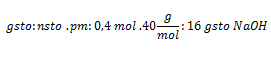
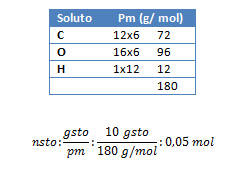
3. Calcule el volumen de solución de agua azucarada de concentración 1 mol/l, que se puede preparar con 10 gramos de azúcar (C6H12O6).
M: 1 mol/l de solución azucarada; gsto: 10 g ; Vsol: ¿?
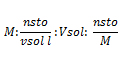
pm C6H12O6: ¿?
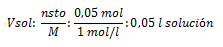
Cabe señalar que el cálculo de la molaridad tiende a confundirse con el cálculo de la molalidad, por lo que podemos encontrar en algunos textos a la molaridad bajo el símbolo “C” y no “M”, ya que este último se le adjudica a la molalidad. También es posible encontrar las designaciones Mr y Ml, para indicar molaridad y molalidad, respectivamente.
Autoevaluación.
1. Determinar la concentración m/l de una solución de 400ml, preparada con 20 g de NaOH.
2. Determine los gramos de solución de 10M en 3 l de solución.
3. Calcule el volumen de solución de concentración 0,003 M, preparada con 25 g de CuSO4
Referencias bibliográficas:
Cuerpo de redacción (1997). Mentor interactivo. Enciclopedia temática estudiantil. Editorial Océano. Barcelona, España. Pág.: 37-40.
Suarez, F (2011). Química teoría. 4to año de Educación media general. Editorial Romor. Caracas, Venezuela. Pág.: 41.