 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Los óxidos son combinaciones binarias, es decir compuestos formados por dos elementos, en donde uno de ellos es el oxígeno, y el otro un metal o un no metal. Como se ha estudiado, los óxidos básicos corresponden a combinaciones binarias de un oxígeno más un metal, por lo que un óxido ácido u anhídrido corresponde a la combinación de oxígeno más un no metal. Los óxidos ácidos deben su nombre a que forman ácidos al reaccionar con el agua.

Según el sistema Stock, los óxidos ácidos se nombran de igual manera que las reglas ya descritas, utilizando la palabra óxido en continuación a la preposición de, luego el nombre del no metal, y por último se escribe en números romanos y entre paréntesis el número de oxidación del no metal. Se mantienen las posiciones del símbolo más electropositivo a la izquierda, mientras que el símbolo del oxígeno, elemento más electronegativo, se coloca a la derecha.
Óxido de + nombre del no metal (número de oxidación)
Estudiemos un ejemplo:

Según la nomenclatura estequiométrica o nomenclatura de proporciones, los compuestos se nombran en función al número de átomos de cada elemento. Se utiliza la siguiente fórmula:
Prefijo + óxido de + prefijo + no metal
Estudiemos los siguientes ejemplos con el no metal azufre:

La I.U.P.A.C recomienda el uso de la nomenclatura Stock y estequiométrica, sin embargo para la nomenclatura antigua o tradicional, se suele utilizar la denominación anhídrido. Siguiendo la fórmula:
Para no metales con número de oxidación: 1, 3, 5, o 7 (bromo, cloro, yodo)

Para no metales con número de oxidación: 4 o 6, 3 o 5 (azufre, nitrógeno, fósforo, arsénico, entre otros)
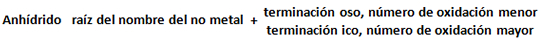
Estudiemos ejemplos para ambos casos de nomenclatura:
a) Con el cloro (Cl): 1, 3, 5 y 7: Cl2O , Cl2O3 , Cl2O5 , Cl2O7
Con el azufre (S): dado que con el azufre solo pueden combinarse con el oxígeno los números de oxidación 4 y 6, se tiene: SO2, SO3
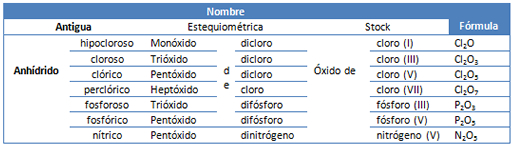
Las tres nomenclaturas descritas pueden compararse al estudiar la siguiente tabla con los elementos, cloro, fósforo y nitrógeno.
Tabla 1. Comparación de nomenclaturas utilizadas para algunos óxidos ácidos.
USOS DE ALGUNOS ÓXIDOS ÁCIDOS
El monóxido de carbono es un gas tóxico, el cual al inhalarse y debido a tu tamaño molecular, tiende a ocupar el lugar del oxígeno en la hemoglobina, por lo que provoca la pérdida de conocimiento, oxidación de tejidos y rápidamente la muerte. El CO puede observarse y olerse a través de los escapes de vehículos (motor) y refinerías de petróleo (Fig. 1). Este gas se utiliza para la extracción y preparación de diferentes compuestos químicos y en la industria metalúrgica.


Figura 1.
El dióxido de carbono, también conocido como el aire que exhalamos, es un gas incoloro, no venenoso en proporciones menores al 10 % en el aire, el cual tiene la capacidad de absorber radiaciones, por lo que contribuye al fenómeno conocido como efecto invernadero. El CO2, se emplea para la preparación de bebidas carbonatadas, en extintores, como refrigerante también llamado hielo seco, entre otros (Fig. 2).



Figura 2.
El sílice u óxido de silicio, es un componente natural de la corteza terrestre, por lo que se extrae de yacimientos. Es utilizado en la fabricación de cemento, ladrillos, vidrio, filtros, entre otros (Fig. 3).



Figura 3.
Autoevaluación
a.- ¿Cómo se forma un óxido ácido? ¿A qué deben su nombre?
b.- Indique y discuta con su profesor la nomenclatura Stock, estequiométrica y antigua de los siguientes óxidos ácidos: NO, CO, CO2, NO2, SiO2, Sb2O3, Br2O, I2O5.
Referencias bibliográficas:
Cuerpo de redacción (1997). Mentor interactivo. Enciclopedia temática estudiantil. Editorial Océano. Barcelona, España. Pág: 410.
Suarez, F (2011). Química teoría. 4to año de Educación media general. Editorial Romor. Caracas, Venezuela. Pág: 11 - 13.